XI.0 Erkrankungen hervorgerufen von Zecken als Überträger,insbesondere Infektionskrankheiten des Menschen in (Zentral-)Europa
Auf dieser in den Fachbereich der Speziellen Zeckenkunde einführenden Internet-Seite wird ein Überblick über das Gefahrenpotential, das ein Stich einer einen Erreger übertragende Zecke für Menschen und (Haus-)Tiere in ⇒ Zentraleuropa darstellt, dargelegt und so soll das Wissenswerteste zu den Erregereigenschaften, deren systematische Zugehörigkeit, zu den Zeckenstich-assoziierten Infektionskrankheit und deren Epidemiologie allgemeinverständlich veranschaulicht werden.
Inhaltsverzeichnis:
- XI.1Zecken als Überträger
- ❍Liste der Krankheitserreger und deren Häufigkeit in heimischen Zecken
- ❍Tabelle der Übertragungsweisen von einigen Zecken-übertragenen Erregern
- ❍Tabelle der Vermehrungsweisen und der Lagen von Erregern in der Zecke
- ❍Tabelle der Zecken-Arten, die als Vektor dienen können, des übertragenen Erregers und des Namens der Erkrankung
- XI.2Einige von Österreichs Zecken übertragene Krankheiten, im Detail dargelegt
- ❍Frühsommer-Meningo-Enzephalitis
- ❍Eyach-Virus
- ❍Louping Ill-Virus
- ❍Krim-Kongo Hämorrhagisches Fieber
- ❍Andere, seltene ARBO-Viren
- ❍Lyme-Borreliose
- ❍Zecken-übertragene Menschliche Ehrlichiosen
- ❍Zecken-übertragene Menschliche Granulozytäre Ehrlichiose
- ❍Q-Fieber
- ❍Mediterranean Spotted Fever
- ❍Babesien-Infektionen
XI. 1 Zecken als Überträger
Zecken übertragen als ⇒ Vektoren (in der Virologie) oder als ⇒ Überträger (in der Parasitologie) eine Vielzahl von tier- und humanpathogenen Erregern, die zu sehr unterschiedlichen Organismengruppen gehören: Viren, Eubakterien, Einzeller (Protozoen) und „Würmer” (heterogene Sammelgruppe). Ein Vektor, von lat. vector = Reisender, Träger, ist ein Überträger von Erregern von Infektionskrankheiten. Wie im Falle anderer Infektionskrankheiten auch muss streng zwischen der Tick-Borne (TB)-Infection und der TB-Disease, also der zumindest akut symptomlosen Infektion und manifesten Krankheit unterschieden werden. Symptomlose, aber infektiöse Wirte tragen wegen ihres unauffälligen Verhaltens und Aussehens mehr zur Ausbreitung einer Seuche bei als schwerkranke und dann meist in ihrer Bewegungsfähigkeit eingeschränkte und gruppendynamisch ausgegrenzte Seuchenopfer.
Im Allgemeinen transportiert ein Vektor oder Überträger einen Erreger von einem infizierten Wirbeltierwirt auf ein anderes, nicht infiziertes Wirbeltier, meist ohne selbst dabei einen für uns erkennbaren körperlichen Schaden zu nehmen. Im Falle einer aktiven Übertragung wird der Erreger von der Zecke während des Blutsaugens in den Darm aufgenommen. Der Erreger überlebt nicht nur im Vektororganismus die Blutverdauung, er kann sich häufig im Vektor intra- oder extrazellulär vermehren und/oder sein Stadium in seinem Lebenszyklus wandeln. Bei der nächsten Nahrungsaufnahme des Vektors wird diese, nun infektionsbereite Einheit einem nicht-infizierten, neuen Blutspender mit Hilfe des Speichels injiziert und dieser neue Wirt so infiziert, falls er empfänglich ist. Die zweite wichtige Übertragungsart in der Medizinischen Entomologie ist die mechanische, auch passive Übertragung genannt. Der Vektor ist nur äußerlich oder auf den oberen Mundwerkzeugen mit dem, meist nicht vermehrungsfähigen Erreger kontaminiert und überträgt diesen mittels eines einfachen Kontakts auf einen anderen Organismus. Diese Übertragungsart ist im Falle von heimischen Zecken selten und ohne wesentliche Bedeutung in der Epidemiologie irgendeiner Krankheit. Dies ist so, weil heimische Schildzecken nicht mehrfach innerhalb einer kurzen Zeitperiode Blut saugen. Andere Übertragungsarten, wie zB Infektionen durch das Essen von Zecken, sind bedeutungslose Kuriosa.
Zecken übertragen Mikroben nicht einfach so, sondern es müssen dafür ganz besondere Bedingungen herrschen: Vor einer Übertragung auf einen Wirbeltierwirt muss die Zecke die Mikrobe selbst erworben haben. Dies kann sie auf zwei Wegen bewerkstelligen: (1) Durch eine vorherige Blutmahlzeit an einem bereits infizierten Wirt und (2) durch eine ⇒ transovarielle Übertragung. Im Falle letzterer ist bereits die erste Larve bei ihrer ersten Blutmahlzeit übertragungsbereit, sonst immer erst ein späteres Stadium. Bei Schildzecken kommt dazu, dass die Mikrobe ⇒ transstadial weitergegeben werden muss, da bei diesen Zecken - im Gegensatz zu Lederzecken - jedes Stadium nur einmal Blut saugt. Und ein-wirtige Zecken-Arten sind als Vektoren ziemlich ungeeignet. Für das Gelingen eines Infektionszyklus, der den Menschen mit einschließt, müssen also einige Voraussetzungen vorliegen:
- Der Vektor muss selbst kompetent sein, dh er muss selbst für den Erreger empfänglich sein und sich als Arthropodenwirt durch seine Potenz zur transovariellen und/oder transstadialen Übertragung eignen.
- Die Populationsdichten des Vektors müssen ausreichend hoch sein um einen ⇒ Befall von Menschen wahrscheinlich zu machen.
- Das Verhalten des Vektors muss so sein, dass mehrfach ein geeigneter Wirbeltierwirt gefunden wird und befallen werden kann, dh in unserem Fall, die Zecke muss ⇒ anthropophil und -phag sein, und auch tatsächlich als frei-lebendes Tier Menschen befallen.
- Der Mensch als Wirt muss sich so verhalten, dass ein Befall mit Zecken, die den Erreger in sich tragen, möglich ist, und diese Zecken auch bis zum Stadium des Blutsaugens gelangen.
- Der Mensch als Art muss für den gegenständlichen Erreger empfänglich sein.
- Das von einer infektiösen Zecke befallene Individuum darf nicht gegen den Erreger immun oder resistent sein.
Man kann daraus leicht ersehen, dass von Zecken übertragene Infektionskrankheiten sehr selten Cluster bilden. In die Infektionsherde, dh in die Populationen von infektiösen Zecken, muss der Mensch aktiv eindringen, zB im Rahmen seiner Berufstätigkeit (Hirten, Berufsjäger, Förster) oder seines Freizeitverhaltens (Freizeitjäger, Hundehalter, Pilzsammler).
Liste der Krankheitserreger und deren Häufigkeit in heimischen Zecken
Die Zecken, deren Fangdaten in diese Liste einflossen, wurden in Österreich über einige Jahre vor dem Publikationszeitpunkt meist mittels Fahnenmethode gefangen. cit. Walder et al. [2006] und Blaschitz et al. [2008]. Die angeführten Häufigkeitswerte dürfen nicht mit dem Infektionsrisiko für den Menschen verwechselt werden. Nicht jede Zecke, die sich mit der Fahne absammeln lässt, sticht auch den Menschen, und nicht alle an Menschen saugende Zecken können Erreger gleich effektiv übertragen.
- FSME-Virus: < 2%
- Borrelia spp.: < 20%
- Brucella sp.: ?, gering
- Coxiella burnetii: < 1%
- Francisella tularensis: < 1%
- Ehrlichia sp.: 7%
- Anaplasma phagocytophilum: 15%
- Rickettsia spp.: 36%
- Babesia spp. inkl.Theileria microti: 51%
Die zwei folgenden Tabellen, XI.1 & XI.2, wurden von mir verändert, erweitert und im Falle neuerer Erkenntnisse auch inhaltlich korrigiert. cit. Dabaghmanesh et al. [2013]; Mehlhorn [1996]; Uilenberg [2006]. Es gilt: Babesia microti und Babesia equi sind Angehörige der Gattung Theileria. Die dritte Tabelle ist so stark erweitert und verändert, dass sie als Original zu bezeichnen ist. Sie wurde initiiert durch Obsomer et al. [2013]. Im Falle der Verfügbarkeit mir neuer Informationen wird die Tabelle XI.3 laufend erweitert und verbessert.
Tabelle der Übertragungsweisen von einigen Zecken-übertragenen Erregern
| Tab. XI.1: Übertragungsweise von einigen Zecken-übertragenen Erregern | |||||||
|---|---|---|---|---|---|---|---|
| Erreger | transstadial | transovariell | beim Fraß von Zecken |
Reurgitation | mechanisch | ||
| Virus | FSME | + | + | - | ? | + | |
| Bakterien | Rickettsia Anaplasma Ehrlichia Borrelia |
+ + + + |
+/- - - ? -, + nur B. miyamotoi |
? ? ? ? |
? ? ? + |
- - - - | |
| Protozoen | Babesien Theilerien Trypanosomen Hepatozoon Leishmania infantum |
+ + - - + kDNS |
+ - - - + kDNS |
- - - + - |
- - + - - |
- - - - - | |
| Würmer | Nematoden | + | - | + | - | + | |
Tabelle der Vermehrungsweisen und der Lagen von Erregern in der Zecke
| Tab. XI.2: Vermehrungsweise und Lage von Erregern in der Zecke | |||||
|---|---|---|---|---|---|
| Erreger | extrazellulär (in der Zecke) |
intrazellulär im Kern |
intrazellulär in Vakuolen |
intrazellulär im Zytoplasma | |
| Viren | FSME | nachweisbar | + | ||
| Bakterien | Rickettsia Anaplasma Ehrlichia Borrelia |
+ |
in primordialen Keimzellen |
+ + |
+ + |
| Protozoen | Babesien Theilerien |
|
|
|
+ + |
| Würmer | Nematoden | + | + | ||
Tabelle der Zecken-Arten, die als Vektor dienen können, des übertragenen Erregers und des Namens der Erkrankung
| Tab. XI.3: Als heimisch vermutete oder heimische Vektorspezies, Erreger und dt. Name von in (Mittel-)Europa vorkommenden, von Zecken übertragenen Krankheiten des Menschen | ||
|---|---|---|
| Zecken-Art | Erreger | Krankheit |
| Argas reflexus | FSME-Virus | Frühsommer-Meningoenzephalitis |
| Coxiella burnetii | Q-Fieber | |
| Argas vespertilionis | Lyssavirus | Tollwut |
| Borrelia burgdorferi sensu lato | Lyme-Borreliose | |
| Coxiella burnetii | Q-Fieber | |
| Ixodes ricinus-Komplex | FSME-Virus | Frühsommer-Meningoenzephalitis |
| Louping-ill-Virus | kein dt: Name | |
| Eyach-Virus | Eyach-Virus Fieber | |
| Erve-Virus | Erve-Virus Fieber | |
| Tribec-Virus | ? Meningoenzephalitis | |
| Lipovnik-Virus | ? Meningoenzephalitis | |
| Uukuniemi Virus | Enzephalitis | |
| Kemerovo-Virus | Meningitis | |
| BHF-Virus | Bukowiener Hämorrhagisches Fieber | |
| CCHF-Virus | Krim-Kongo-Hämorrhagisches Fieber cit. Bursali et al. [2013] | |
| Borrelia afzelii | Hautborreliose | |
| Borrelia garinii | Neuroborreliose | |
| Borrelia lusitaniae | Lyme-Borreliose | |
| Borrelia miyamotoi | Rückfallfieber | |
| Borrelia valaisiana | ? Lyme-Borreliose | |
| Borrelia spielmanii | Lyme-Borreliose | |
| Borrelia burgdorferi sensu lato | Lyme-Borreliose | |
| Rickettsia helvetica | unbestätigter Erreger einer Meningitis | |
| Rickettsia monacensis | unbestätigt als Erreger | |
| Coxiella burnetii | Q-Fieber | |
| Anaplasma phagocytophilum | Granulozytäre Ehrlichiose | |
| Candidatus Neoehrlichia mikurensis | Neoehrlichiose | |
| Francisella tularensis | Tularämie | |
| Babesia divergens B. bovis B. venatorum Theileria microti | Babesiosen | |
| Ixodes acuminatus | Bhanja-Virus | Fieber, Enzephalitis |
| Borrelia burgdorferi sensu lato | Lyme-Borreliose | |
| Francisella tularensis | Tularämie | |
| Coxiella burnetii | Q-Fieber | |
| Ixodes canisuga | FSME-Virus | Frühsommer-Meningoenzephalitis |
| Borrelia burgdorferi sensu lato | Lyme-Borreliose | |
| Yersinia pestis | Pest (nur in Russland nachgewiesen) | |
| Ixodes frontalis | Bahig-Virus | ? |
| Matruh-Virus | ? | |
| Kemerovo-Virus | Kemerovo tickborne viral fever | |
| Borrelia afzelii | Hautborreliose | |
| Borrelia garinii | Neuroborreliose | |
| Borrelia burgdorferi sensu lato | Lyme-Borreliose | |
| Coxiella burnetii | Q-Fieber | |
| Ixodes inopinatus | Borrelia afzelii | Hautborreliose |
| Borrelia lusitaniae | Lyme-Borreliose | |
| Anaplasma phagocytophilum | Granulozytäre Ehrlichiose | |
| Rickettsia helvetica | Unbestätigter Erreger einer Meningitis | |
| Ixodes persulcatus | FSME-Virus ? | Frühsommer-Meningoenzephalitis |
| OHF-Virus | Omsker Hämorrhagisches Fieber | |
| Kemerovo-Virus | Meningitis | |
| Borrelia afzelii | Hautborreliose | |
| Borrelia garinii | Neuroborreliose | |
| Borrelia valaisiana | ? Lyme-Borreliose | |
| Rickettsia helvetica | unbestätigter Erreger einer Meningitis | |
| Borrelia burgdorferi sensu lato | Lyme-Borreliose | |
| Ehrlichia muris | Monozytäre Ehrlichiose | |
| Anaplasma phagocytophilum | Granulozytäre Ehrlichiose | |
| Theileria microti | Babesiose | |
| Ixodes (Exopalpiger) trianguliceps | FSME-Virus | Frühsommer-Meningoenzephalitis |
| Borrelia afzelii | Hautborreliose | |
| Borrelia garinii | Neuroborreliose | |
| Borrelia burgdorferi sensu lato | Lyme-Borreliose | |
| Coxiella burnetii | Q-Fieber | |
| Anaplasma phagocytophilum | Granulozytäre Ehrlichiose | |
| Francisella tularensis | Tularämie | |
| Theileria microti | „Babesiose” | |
| Ixodes (Pholeoixodes) arboricola | FSME-Virus | Frühsommer-Meningoenzephalitis |
| Borrelia afzelii | Hautborreliose | |
| Borrelia garinii | Neuroborreliose | |
| Borrelia valaisiana | ? Lyme-Borreliose | |
| Borrelia spielmanii | Lyme-Borreliose | |
| Borrelia burgdorferi sensu lato | Lyme-Borreliose | |
| Ixodes (Pholeoixodes) hexagonus | FSME-Virus | Frühsommer-Meningoenzephalitis |
| Erve-Virus | Erve-Virus Fieber | |
| Borrelia afzelii | Hautborreliose | |
| Borrelia garinii | Neuroborreliose | |
| Borrelia lusitaniae | Lyme-Borreliose | |
| Borrelia valaisiana | ? Lyme-Borreliose | |
| Borrelia spielmanii | Lyme-Borreliose | |
| Borrelia burgdorferi sensu lato | Lyme-Borreliose | |
| Rickettsia conorii | Mittelmeerfleckfieber | |
| Rickettsia helvetica | unbestätigter Erreger einer Meningitis | |
| Anaplasma phagocytophilum | Granulozytäre Ehrlichiose | |
| Theileria microti | „Babesiose” | |
| Ixodes (Eschatocephalus) vespertilionis | FSME-Virus | Frühsommer-Meningoenzephalitis |
| Dermacentor reticulatus | FSME-Virus | Frühsommer-Meningoenzephalitis |
| OHF-Virus | Omsker Hämorrhagisches Fieber | |
| Borrelia burgdorferi sensu lato | Lyme-Borreliose | |
| ? Rickettsia slovaca | TIBOLA (Zecken-übertragene Lymphadenopathie) | |
| Rickettsia sibirica | Sibirisches Zeckenfleckfieber | |
| Rickettsia helvetica | unbestätigter Erreger einer Meningitis | |
| Rickettsia conorii | Mittelmeerfleckfieber | |
| Bartonella henselae | Katzenkratzkrankheit | |
| Coxiella burnetii | Q-Fieber | |
| Francisella tularensis | Tularämie | |
| Babesia divergens | Babesiose | |
| Theileria microti | „Babesiose” | |
| Dermacentor marginatus | OHF-Virus | Omsker Hämorrhagisches Fieber |
| Erve-Virus | Erve-Virus Fieber | |
| Bhanja-Virus | Arbovirose | |
| Rickettsia slovaca | TIBOLA (Zecken-übertragene Lymphadenopathie) | |
| Coxiella burnetii | Q-Fieber | |
| Francisella tularensis | Tularämie | |
| Haemaphysalis concinna | FSME-Virus | Frühsommer-Meningoenzephalitis |
| Anaplasma phagocytophilum | Granulozytäre Ehrlichiose | |
| Borrelia afzelii | Hautborreliose | |
| Rickettsia sibirica | Sibirisches Zeckenfleckfieber | |
| Rickettsia helvetica | unbestätigter Erreger einer Meningitis | |
| Coxiella burnetii | Q-Fieber | |
| Francisella tularensis | Tularämie | |
| Haemaphysalis punctata | FSME-Virus | Frühsommer-Meningoenzephalitis |
| Tribec-Virus | ? Meningoenzephalitis | |
| Lipovnik-Virus | ? Meningoenzephalitis | |
| Bhanja-Virus | Arbovirose | |
| CCHF-Virus | Krim-Kongo-Hämorrhagisches Fieber | |
| ? Coxiella burnetii | Q-Fieber | |
| Haemaphysalis inermis | Rickettsia slovaca | TIBOLA (Zecken-übertragene Lymphadenopathie) |
| Haemaphysalis sulcata | Bhanja-Virus | Arbovirose |
| Hyalomma marginatum | Rickettsia aeschlimannii | Spotted Fever |
| CCHF-Virus | Krim-Kongo-Hämorrhagisches Fieber | |
| Bhanja-Virus | Arbovirose | |
| Rhipicephalus sanguineus | Lipovnik-Virus | ? Meningoenzephalitis |
| CCHF-Virus | Krim-Kongo-Hämorrhagisches Fieber | |
| Borrelia burgdorferi sensu lato | Lyme-Borreliose | |
| Anaplasma phagocytophilum | Granulozytäre Ehrlichiose | |
| Rickettsia africae | Afrikanisches Zeckenbissfieber ATBF | |
| Rickettsia aeschlimannii | Spotted Fever | |
| Rickettsia conorii | Mittelmeerfleckfieber | |
| Rickettsia massiliae | Spotted Fever | |
| Coxiella burnetii | Q-Fieber | |
| Babesia bigemina | Babesiose der Splenektomierten | |
| ? Leishmania infantum nur kDNS | Leishmaniose | |
XI. 2 Einige von Österreichs Zecken übertragene Krankheiten, im Detail dargelegt
- Frühsommer-Meningo-Enzephalitis
- Eyach-Virus
- Louping Ill-Virus
- Krim-Kongo hämorrhagisches Fieber
- Andere, seltene ARBO-Viren
- Lyme-Borreliose
- Zecken-übertragene Menschliche Ehrlichiosen
- Zecken-übertragene Menschliche Granulozytäre Ehrlichiose
- Q-Fieber
- Mediterranean Spotted Fever
- Babesien-Infektionen
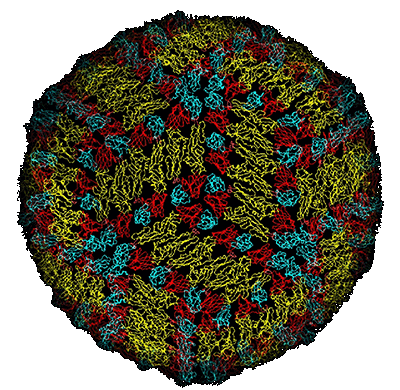
Das Virus der Frühsommer-Meningo-Enzephalitis (FSME)
Abb. XI.1: Ein Oberflächen-Modell des FSME-Virus. © unbekannt.
Über das Virus der Frühsommer-Meningo-Enzephalitis oder Hirnhautentzündung, aber auch für ARBO-Viren generell besteht die gefestigte Lehrmeinung, dass das Virus im Wirtstier eine Virämie (= Viren im Blut) mit genügend hohem Virustiter induzieren muss, damit sich der blutsaugende Vektor, in unserem Fall die Zecke, infizieren kann. Für Tiere der meisten Wirtsarten ist das FSME-Virus allerdings apathogen, einzelne Individuen erkranken nur ausnahmsweise. Ein infizierter Wirt bildet spezifische Antikörper gegen das FSME-Virus und ist dann zeitlebens immun gegen eine erneute Infektion - oder genauer, er bildet keine messbare Virämie mehr aus. Da unter diesen Gesichtspunkten ein Kreislauf des FSME-Virus in der Natur bald zum Erliegen käme, müssen für die Persistenz eines Naturherdes folgende Bedingungen gegeben sein:
- das Vorkommen von Wirtstieren mit genügend langer Dauer der Virämie und hohem Virustiter
- eine ausreichende Zahl infizierbarer Jungtiere
- ein Angebot unterschiedlicher Formen von Wirtstieren
- die Existenz größerer Wirtstiere mit mehrfachem Zeckenbefall
Virämiedauer: Eine lang dauernde virämische Phase (2-8 Tage) mit hohem Virustiter wird am ehesten bei Kleinsäugern wie der Gelbhalsmaus, der Rötelmaus, der Feldmaus, der Haselmaus etc. beobachtet. An ihnen können sich die Zecken daher am leichtesten infizieren. Das FSME-Virus kann in diesen Wirten überwintern, wobei die Dauer der Virämie von der Körper- und der Umgebungstemperatur stark abhängt. In der kälteren Jahreszeit ist sie zB beim Stachelschwein von 3 bis 6 Tagen auf 8 bis 14 Tage verlängert. Bei großen Säugetieren (Reh, Ziege) tritt nur eine kurzdauernde Virämie mit niedrigen Virustitern auf. Neuere Untersuchungen deuten jedoch darauf hin, dass bei Mehrfachbefall größerer Säugetiere auch eine gering-virämische Übertragung des Virus auf die Zecken eine Rolle im Viruszyklus spielen kann. Zudem sondern Ziege, Kuh und Schaf während der Virämie virushaltige Milch ab und können mittels der oralen Aufnahme von Milch zur Infektionsquelle für den Menschen werden. Insbesondere im Fall von Weidehaltung der genannten Nutztiere ist an einen derartigen Infektionsweg zu denken. Vom Genuss roher Milch von freigehenden Weidetieren ist daher dringend abzuraten.
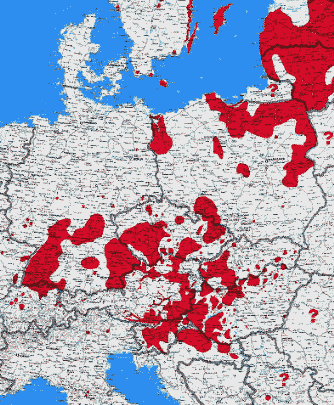
Abb. XI.2: Die Verbreitung der FSME in Europa.
© A. Hassl, 2021.
Risikogebiete für eine Infektion mit diesem Virus liegen in Süddeutschland (Bayern, Baden-Württemberg), Österreich und der Schweiz, aber auch in Südschweden und-norwegen, Polen und anderen nordeuropäischen Staaten. Im Falle des Nicht-Geimpft-Seins - oder genauer: Des Vorliegens einer immunologischen Naivität - sollte man sich vor Antritt seines Camping-Urlaubs über die lokale Infektionsgefahr erkundigen. FSME-Naturherde bestehen meist in ⇒ Biotopen, die optimale Bedingungen für die Existenz des Holzbocks und seiner Wirte bieten. Die meisten der bisher genau lokalisierten Infektionsorte liegen an Übergangszonen zwischen verschiedenen Vegetationsformen. Infizierte Zecken treten bevorzugt an Waldrändern mit angrenzenden Wiesen, Waldlichtungen, Bach- oder Flussauen, Schonungen mit Unterholz und Hecken, Übergängen von Laub- zu Nadelwald und Hoch- zu Niederwald auf. Betroffen sind ebenso Eichen-/Hainbuchen- und Buchen-/Tannen-Wälder mit einer gutentwickelten Krautschicht (Farne usw.) sowie Strauchbeständen von Holunder, Hasel und Brombeeren. Sehr häufig finden sich Infektionsorte an wärmeren Südhanglagen mit niedrigem Strauchwerk und Hecken. Diese Landschaften ziehen viele Erholungssuchende an, insbesondere wenn Bänke, Waldlaufpfade oder Grillplätze vorhanden sind, sodass hier mit einem erhöhten Infektionsrisiko zu rechnen ist. In Österreich geht allerdings seit der Jahrtausendwende die FSME-Inzidenzrate in Gebieten unter 400m Seehöhe zurück. cit. Heinz et al. [2013]. Verschiedene Untersuchungen haben gezeigt, dass FSME-Naturherde meist nicht durch eine Kultivierung der Landschaft beseitigt werden können. Durch die Einengung der Kleintierbiotope auf die nicht kultivierten Restgebiete wird im Gegenteil die Zirkulation des FSME-Virus noch verstärkt, da die höhere Populationsdichte der Wirtstiere eine höhere Übertragungswahrscheinlichkeit mit sich bringt. Nach älteren Untersuchungen an 41.000 Ixodes ricinus-Zecken waren 1978 in Süddeutschland und Österreich 0,11% mit dem FSME-Virus durchseucht. cit. Rehse-Küpper et al. [1978].
FSME äußert sich oft durch Kopfschmerzen und/oder Fieber (die sog. Sommergrippe). Die Symptome können aber sehr schwach sein. Dennoch ist es wichtig, dass man sich schnell behandeln lässt. Solange die Krankheit noch nicht sehr weit fortgeschritten ist, kann man sich nach der Infektion noch Antiseren verabreichen lassen. Eine klinisch manifeste FSME kann bleibende Schäden, wie Lähmung, aber sogar den Tod zur Folge haben. Gegen die FSME gibt es eine vorbeugende Impfung.
Die Frühsommer-Meningoenzephalitis (FSME) hat seit Mitte der siebziger Jahre des vorigen Jahrhunderts in ganz Europa und Fernost erheblich an Bedeutung gewonnen, die Zahl der registrierten Erkrankungen hat zugenommen und die Risikogebiete haben sich ausgedehnt. Für diese Entwicklung ist eine Reihe von Faktoren verantwortlich zu machen (globale Erwärmung, höhere Aufmerksamkeit, bessere Diagnostik, Änderungen im politischen, sozialen und ökonomischen Bereich). Bei der hohen Qualität und Immunogenität der auf dem Markt befindlichen FSME-Impfstoffe für Kinder und Erwachsene dürfte die Zurückdrängung der FSME heute kein Problem sein. Für eine wissenschaftlich begründete Impfstoffapplikation (Indikationsimpfung) ist die ständige Überwachung der FSME-Risikogebiete und die Aktualisierung der Datenbanken wesentliche Voraussetzung. Die epidemiologischen Daten zur Ausdehnung von Risikogebieten und zum Risikoniveau sind sowohl für Deutschland als auch für die meisten europäischen Länder mit einem FSME-Risiko verfügbar und können für reisemedizinische Zwecke genutzt werden. cit. Süss [2005].
Eyach-Virus
Das Eyach-Virus, ein Virus der Familie Reoviridae, kommt in Europa vor und ist mit dem Colorado Tick Fever-Virus serologisch nahe verwandt. Aufgrund der Ähnlichkeit dieser beiden Viren wurde eigens die Gattung Coltivirus innerhalb der Familie der Reoviridae eingerichtet. Das Eyach-Virus wurde erstmals 1981 in Westfrankreich in Zecken der Spezies Ixodes ricinus nachgewiesen. Seine geographische Verbreitung umfasst nach heutigem Wissensstand Deutschland, Frankreich, Tschechien und die Niederlande. Das Eyach-Virus gilt heute als humanpathogen. Es wird ihm eine Rolle als Verursacher neurologischer Krankheitsbilder wie Meningoenzephalitis zugeschrieben. cit. Daxböck et al. [1999].
Das Louping Ill-Virus
Das Louping Ill-Virus ist ein Flavivirus aus der Familie Flaviviridae und es ist nach den charakteristischen Krankheitsymptomen der Schafe benannt. Vier unterschiedliche Serotypen kommen in Großbritannien und Irland vor. Ein fünfter Serotyp wurde 1993 in Norwegen identifiziert. Das Virus ist für Schafe hoch pathogen, bei denen die Infektion zu neurologischen Symptomen führen kann. Kontakt mit diesen Tieren ist neben den Stichen von Ixodes ricinus eine Infektionsquelle für den Menschen. Ziegen stellen zwar kein bedeutendes ⇒ Reservoir für das Louping Ill-Virus dar, es ist aber bekannt, dass die Milch virämischer Tiere potentiell ebenfalls eine Infektionsquelle ist. Von den beschriebenen Infektionen beim Menschen geht fast ein Drittel auf den Umgang mit dem Erreger in Laboratorien zurück. Das Louping Ill-Virus ist seit 1934 als humanpathogen beschrieben. Vier verschiedene Verlaufsformen der Infektion wurden seitdem beschrieben. Die durch das Louping Ill-Virus hervorgerufene Enzephalitis verläuft biphasisch. Nach einer Inkubationszeit von 4 bis 7 Tagen kommt es zu grippeähnlichen Symptomen. Diese dauern 2 bis 11 Tage an. Darauf folgt eine 5 oder 6 Tage anhaltende Remission. Der zweite Schub der Erkrankung verläuft unter dem Bild einer Meningoenzephalitis und dauert 4 bis 10 Tage. Während der ersten Krankheitsphase besteht eine ⇒ Leukozytopenie, später eine ⇒ Leukozytose. Die Diagnose der Louping Ill-Enzephalitis kann serologisch gestellt werden. Die Isolierung des Virus gelingt während der ersten Krankheitsphase aus dem Blut, später aus dem Liquor cerebrospinalis. Des Weiteren kann die Infektion mit dem Louping Ill-Virus unter dem Bild einer ⇒ Poliomyelitis, eines ⇒ hämorrhagischen Fiebers oder eines grippalen Infekts verlaufen. Nicht selten bleibt die Infektion gänzlich asymptomatisch. cit. Daxböck et al. [1999].
Das Virus des Krim-Kongo-Hämorrhagischen Fiebers
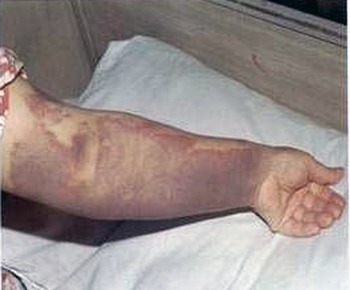
Abb. XI.3: Das Krim-Kongo-Hämorrhagische Fieber.
© Mardani et Keshtkar-Jahromi [2007].
Der Erreger des Krim-Kongo Hämorrhagischen Fiebers ist ein Nairovirus aus der Familie der Bunyaviridae. Es ist ein bis 120nm großes Einzelstrang-RNA-Virus mit negativer Polarität (ss-) und Glykoprotein-Spikes von 10 nm Länge. Es wurden vier oder fünf Euroasiatische und drei Afrikanische Typen gefunden. Die Erkrankung wurde schon im 12. Jhd. in Tadschikistan beschrieben, dann 1944 während eines Ausbruchs auf der Krim, das Virus wurde 1967 im Kongo erstmals isoliert. Als Reservoirtiere mit Seroprävalenzen von bis zu 35% gelten Pferde, Schafe, Ziegen, Rinder und Schweine, wobei diese Tiere von den erwachsenen Hyalomma-Zecken als Wirtstiere genutzt werden. Über die Infektionsraten von Hasen, Igeln und Vögeln, die von den subadulten Zecken als Blutspender bevorzugt werden, konnte ich keine Angaben finden. Die genannten Wirbeltiere werden hauptsächlich durch Zecken verschiedener Gattungen, die als Vektoren fungieren, infiziert, selten nur durch Kontakt mit Körperflüssigkeiten. Die wichtigsten Vektoren stellt die Gruppe der subadulten Zecken der Gattung Hyalomma, insbesondere Nymphen der Arten H. anatolicum, H. rufipes, H. truncatum und, als bedeutendster Vektor, Hyalomma marginatum. Eine Verschleppung des Virus durch den Vogelzug ist die wahrscheinlichste Ursache eines Ausbruchs des Krim-Kongo-Hämorrhagischen Fiebers in der Türkei im Jahre 2002.
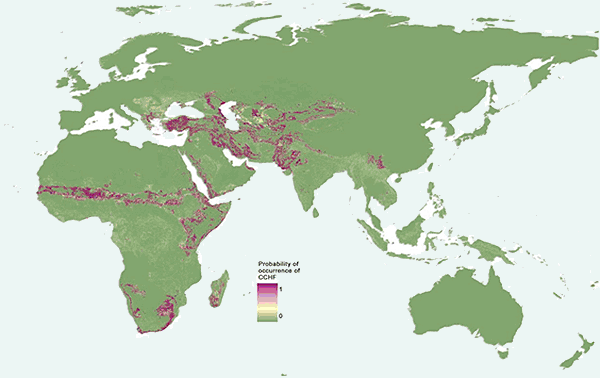
Abb. XI.4: Die Verbreitung des Krim-Kongo-Hämorrhagischen Fiebers.
© Messina et al. [2015].
Etwa 500 Erkrankungen des Menschen werden jährlich weltweit bekannt, davon enden 15 bis 30% tödlich. Die Erkrankung tritt in weiten Teilen Asiens und Afrikas auf, wie aus der Karte zu ersehen ist. In Europa sind Erkrankungsfälle aus Bulgarien, Albanien, dem ehemaligen Jugoslawien und Russland bekannt geworden. Für den Menschen stellt der Kontakt mit Blut oder Fleisch von virämischen Tieren und Menschen, bei denen die Infektion asymptomatisch verläuft, die wichtigste Infektionsquelle dar, eher selten der Zeckenstich. Die Übertragung von Mensch zu Mensch ist ebenfalls möglich. Die Ansteckung von Krankenhauspersonal durch erkrankte Patienten ist selten. Die Erkrankung verläuft zumeist unter dem Bild eines akuten ⇒ hämorrhagischen Fiebers. Die hämorrhagischen Erscheinungen umfassen Haut- und Schleimhautblutungen sowie Blutungen des Gastrointestinal- und Urogenitaltrakts. Nicht selten zeigen die erkrankten Patienten allerdings überhaupt keine hämorrhagischen Läsionen. Die Symptomatik umfasst zudem hohes Fieber, Erbrechen und Diarrhoe. Wie auch bei anderen Formen von hämorrhagischem Fieber ist die Leber in den Krankheitsprozess involviert. Die Serumaktivität der GOT und der CK ist erhöht, ebenso der Bilirubinspiegel. Manche Patienten weisen einen Ikterus auf. Eine früh auftretende massive ⇒ Thrombozytopenie deutet auf einen letalen Ausgang hin. Die ⇒ Mortalität des Krim-Kongo-Hämorrhagischen Fiebers beträgt je nach Krankheitsherd bis zu 80%. Nur in seltenen Fällen verläuft die Infektion asymptomatisch. Mit Ribavirin steht eine wirksame Therapie zur Verfügung. Es muss aber früh im Verlauf der Erkrankung mit der Behandlung begonnen werden, um die Prognose beeinflussen zu können. cit. Daxböck et al. [1999].
Andere ARBO (arthropode borne)-Viren:
Zecken können in Europa auch zahlreiche andere, weniger bekannte Viren auf den Menschen und auf Tiere übertragen, so zB Uukuniemi-Virus oder das sehr gefährliche Krim-Kongo-Hämorrhagisches Fieber-Virus, das von Zugvögeln verschleppt werden könnte, jedoch vermutlich nicht (regelmäßig) nach Österreich eingeschleppt wird. Die Basis für diese Annahmen liefert die Tatsache, dass man schätzt, dass jährlich etwa 600 Mill Zugvögel von Afrika nach Europa und zurück wandern. Etwa jeder 30. Vogel beherbergt Zecken, wobei die durchschnittliche Infestationsrate bei 1,7 Zecken pro Vogel liegt. cit. Nuorteva et Hoogstraal [1963]. Daraus kann man vermuten, dass jährlich etwa 7 Mill Zecken über weite Strecken verschleppt werden. Da ich mich mit diesem Thema sehr ausführlich im Rahmen einer Dissertation beschäftigt habe, hier eine knappe Darstellung der epidemiologischen Situation:
Einleitung: Die disjunkte Verbreitung vieler ARBO-Viren und ihr zeitlich unregelmäßiges Auftreten innerhalb ihres Verbreitungsareales führen zu der Frage, ob diese ARBO-Viren aus ⇒ endemischen Herden mehr oder minder regelmäßig verschleppt werden. Ein Transport eines ARBO-Virus über größere Entfernungen ist sicherlich nur unter besonderen Bedingungen und nur mit Hilfe bestimmter Wirte möglich. Zur Untersuchung der Frage, ob Zugvögel für die Einschleppung von durch Zecken übertragenen ARBO-Viren nach ⇒ Zentraleuropa von Bedeutung sind, wurde im Rahmen meiner Dissertation ein breit angelegtes Untersuchungsprogramm in Ostösterreich durchgeführt. Die durch Stechmücken übertragenen ARBO-Viren waren Gegenstand einer zweiten Arbeit, die auf demselben Material beruhte. Aus meiner Dissertation eine Kurzfassung:
Diskussion: Aus den erhobenen arbovirologisch-serologischen Befunden lassen sich folgende Schlussfolgerungen über das Auftreten von durch Zecken übertragenen ARBO-Viren im Neusiedlerseegebiet ziehen: Das wichtigste heimische ARBO-Virus, das Virus der Frühsommer-Meningoencephalitis, tritt zwar in Vögeln auf, doch kommt diesen Wirten für die Aufrechterhaltung des Zyklus keinerlei Bedeutung zu. Es kommt in der Umgebung des Neusiedlersees vor, jedoch nicht am Illmitzer Ufer.
Bhanja, ein mit Schafen und Ziegen assoziiertes mediterranes Virus, kommt in Ostösterreich und in angrenzenden Gebieten offenbar nicht vor. Dies kann man auf das Fehlen größerer Bestandsdichten der Hauptwirte oder aber auch auf das Fehlen des Vektors (Haemaphysalis punctata) zurückführen.
Das Uukuniemi-Virus, ein in Nordeuropa mit Vögeln auf das engste verbundene ARBO-Virus, dürfte in ⇒ Zentraleuropa ähnliche Biotope bevorzugen wie das FSME-Virus. Es scheint weitgehend zwischen Ixodes ricinus-Zecken und Kleinsäugern zu kreisen oder aber fast ausschließlich durch vertikale Übertragung in der Zeckenpopulation zu persistieren. Wie aus Tabelle 1 ersichtlich ist, konnte kein einziger Vogel mit Antikörpern gegen das Congo-Crimean Hemorrhagic Fever-Virus ermittelt werden. Vögel dürften daher tatsächlich, wie in der Literatur öfters angegeben, refraktär gegen dieses Virus sein. Überraschend waren die Nachweise von Antikörpern gegen Bahig/Matruh in Jungvögeln und in einem Wiesel, wodurch sich ein gewichtiger Anhaltspunkt für das Vorkommen dieser bisher in ⇒ Zentraleuropa nicht bekannten ARBO-Viren ergibt. Die beiden Viren wurden in Italien 1968/69 isoliert, weitere Untersuchungen liegen nicht vor.
Die Etablierung von Zyklen von durch Zecken übertragenen ARBO-Viren im Schilfgürtel des Neusiedlersees und damit die erfolgreiche Einschleppung solcher Viren durch Zugvögel in diesen ⇒ Biotopen hat nur geringe Chancen. Der Schilfgürtel besitzt zwar einen außergewöhnlichen Vogelreichtum, ist aber für Zecken ein weitgehend ungeeigneter Lebensraum. Die Zahl der nachgewiesenen Zeckenspezies ist entsprechend gering und die ⇒ Abundanz ausgesprochen niedrig. Dies erschwert den Aufbau eines Zyklus beträchtlich, auch wenn ein ARBO-Virus nicht durch einen virämischen Vogel, sondern durch eine am Vogel saugende, virämische Zecke eingeschleppt wird. Da diese Zecken den heimischen Winter nur selten überstehen, muss das Virus rechtzeitig auf einen heimischen Vektor oberwechseln. Diese Lebensraumänderung erscheint umso schwieriger, je verschiedenartiger die involvierten Biotope sind. Obwohl die Einschleppung nicht-heimischer Zecken nach ⇒ Zentraleuropa nach Befunden anderer Autoren als wahrscheinlich anzusehen ist, erscheint uns die Etablierung eines Kreislaufs eines nicht-heimischen ARBO-Virus aus den oben genannten Gründen schwierig.
Zusammenfassung: Zur Beurteilung der Frage nach der Möglichkeit der Einschleppung nicht ⇒ autochthoner ARBO-Viren durch Zugvögel wurde in den Jahren 1979 und 1980 ein breit angelegtes Untersuchungsprogramm durchgeführt. Dabei wurden etwa 6000 Sera von Kleinvögeln, Jagdwild und Kleinsäugern aus dem Seewinkelgebiet/Neusiedlersee (Ostösterreich) serologisch gegen Frühsommer-Meningoencephalitis-Virus, Bhanja-Virus, Uukuniemi Virus, Congo-Crimean Hemorrhagic Fever-Virus und Bahig/Matruh-Viren und 1632 Blutproben virologisch untersucht. Die Virusisolierungsversuche verliefen durchwegs negativ, während die serologischen Untersuchungen zum Nachweis von Antikörpern gegen Frühsommer-Meningoencephalitis, Bhanja, Uukuniemi und Bahig/Matruh und damit zum erstmaligen Nachweis des Vorkommens von Viren der Tete-Gruppe in Österreich führten. Die Gefahr der Einschleppung von durch Zecken übertragenen ARBO-Viren durch Zugvögel erscheint aus ⇒ ökologischen Gründen gering. Verändert cit. Hassl et Aspöck [1982].
Genauere Informationen zum Thema Zecken, ARBO-Viren und Vögel gibt es immer noch nur in der Zusammenfassung meiner Dissertation.
Lyme-Borreliose:

Abb. XI.5: Wanderröte der Lyme-Borreliose. ©: unbekannt.
Die Borreliose ist eine Bakterienerkrankung, die sich oft, aber nicht immer, durch eine kreis-oder ringförmige Rötung um die Stichstelle ankündigt. Diese Rötung kann anfangen, ihre Lage zu verändern (sog. Wanderröte). Die Borreliose kann durch Antibiotika behandelt werden, kann aber, wenn sie nicht behandelt wird, ebenfalls schwerwiegende Folgen haben. Es existieren bei uns (anders als in den USA) mehrere (wahrscheinlich drei) unterschiedliche bakterielle Erreger, B. garinii, B. afzelii und B. burgdorferi, die die Lyme-Borreliose verursachen. Dies hat auch zur Folge, dass es in ⇒ Zentraleuropa (noch) keine Impfung für den Menschen gibt. Die Borreliose selbst ist in vermutlich in ganz ⇒ Zentraleuropa verbreitet. Man schätzt, dass etwa 4% der Zecken mit Borrelien infiziert sind. ⇒ Reservoire für die Bakterien sind Mäuse, Rotwild und der Igel, hingegen können sich die Bakterien in Vögeln und Reptilien (= Wirte der Zecken) nicht vermehren. Die Bakterien leben im Verdauungstrakt der Zecke und brauchen nach dem Stich der Zecke normalerweise einige Stunden, um in den Blutkreislauf des Menschen zu gelangen. Dies hängt mit der Eigenheit der Zecken zusammen, zwar meist sehr gute Wirte für Krankheitskeime zu sein, diese aber sehr schlecht und ineffizient zu übertragen. Deshalb ist es wichtig, Zecken so schnell wie möglich vom Wirt zu entfernen.
Zecken-übertragene Menschliche Ehrlichiosen (HME):
Die Kenntnis der Erreger von humanen Ehrlichiosen ist gering. Es können verschiedene Szenarien vertreten werden:
- Es gibt nur ein Bakterium, mit der Bezeichnung Anaplasma phagocytophilum (Foggie, 1949) Dumler et al., 2001 oder Ehrlichia sp., das eine fieberhafte Erkrankung nach Zeckenstich auslöst und unterschiedliche biologische und pathogene Eigenschaften aufweist, je nach Wirtsart und Gegend. (Taxonomie: Raffer!).
- Ehrlichia sp. ist in Europa ein tierpathogener Stamm von Anaplasma phagocytophilum, die Bezeichnung daher als Stammkennzeichnung gültig.
- Anaplasma phagocytophilum und Ehrlichia sp. (ev. E. canis) sind eindeutig differenzierbar und daher verschiedene, wenn auch nahe verwandte und ähnliche Organismen (Taxonomie: Lumper!).
- Anaplasma phagocytophilum und Ehrlichia canis (Donatien et Lestoquard, 1935) sind völlig unterschiedlich, vielleicht nicht einmal näher verwandt; ersteres erregt beim Menschen die Granulozytäre Ehrlichose (HGE) und das Weidefieber bei Wiederkäuern, letzteres die Monozytäre Ehrlichose (HME), die aber nur für Hunde wirklich pathogen zu sein scheint.
Ich folge im Weiteren der drittgenannten Ansicht, weil Anaplasma in Europa von einem breiteren Zeckenspektrum übertragen wird, andere Wirbeltierwirte bevorzugt (Rehe (95% seropositiv), Hirsche, Wildschweine, Rinder, Schafe, Pferde vs. Hunde, Mäuse), und Wildtiere als Reservoirwirte nutzt; Ehrlichia ist im Gegensatz zu Anaplasma nicht pathogen für den Menschen, kann diesen jedoch nachweislich infestieren. Serologisch nachgewiesene Infestationen mit einem der beiden Keime betreffen in Österreich etwa 7% der Bevölkerung. Mangels eines greifbaren Krankheitsbildes der HME wird auf diese nicht weiter eingegangen.
Zecken-übertragene Menschliche Granulozytäre Ehrlichiose (HGE):
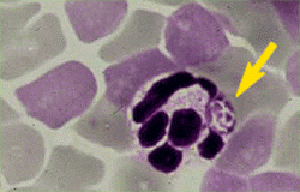
Abb. XI.6: Granulozytäre Ehrlichiose: Intrazelluläres Kluster an Bakterien. ©: unbekannt.
Begründet auf Studien zur Seroprävalenz und den Infektionsraten von Zecken wird angenommen, dass die Zecken-übertragene Menschliche Granulozytäre Ehrlichiose (HGE) auch in ⇒ Zentraleuropa auftritt, obgleich bislang zumindest in Deutschland kein klinisch manifester Fall beim Menschen gefunden worden ist. Die akute Erkrankung tritt nur in den Sommermonaten auf und ist durch Fieber, Myalgien (Muskelschmerzen) und Rigor (Muskelsteife) gekennzeichnet. Die ⇒ Letalität beträgt etwa 5%. Es gibt zudem eine chronische Verlaufsform, die durch rekurrierende Fieberschübe mit schweren Allgemeinsymptomen gekennzeichnet ist. Medikament der ersten Wahl ist Doxycyclin. cit. Hassler et al. [2003]. Bekannt ist diese Erkrankung von Pferden, Reservoirwirte sind Schafe, Pferde, Hunde. Der Erreger ist ein kleines, obligat intrazellulär lebendes, gramnegatives Bakterium, wahrscheinlich Anaplasma phagocytophilum oder eine sehr nahe verwandte Anaplasma-Art, siehe Bild rechts, ein Blutausstrich vom Hamster. DNS dieses Bakteriums konnte in 10% der Zecken (Ixodes ricinus) und in ausländischen Ehrlichiose-Patienten nachgewiesen werden, sowie spezifische serologische Reaktionen bei Deutschen gegen Anaplasma-Antigene. Das Fehlen von Krankheitsfällen scheint daher eher auf einem Kenntnismangel zu beruhen denn auf das Fehlen von Erregern und infizierten ⇒ Überträgern. Verändert cit. von Loewenich et al. [2003].
Q-Fieber:
Basierend auf einer Studie aus Ungarn und der Slowakei wird auch das Q-Fieber, erregt durch die Rickettsie Coxiella burnetii (Derrick, 1939), einem kleinen, gramnegativen, intrazellulären und sehr umweltresistenten Stäbchen, in die Gruppe der durch Zecken übertragbaren, mitteleuropäischen Infektionskrankheiten aufgenommen, obwohl es sich nach der Lehrmeinung um eine Zoonose (Hauptübertragungsweg: tierische Produkte und Säugerkot) handelt. cit. Spitalska et Kocianova [2003]. Immerhin konnten lokal 21% der Dermacentor marginatus- und bis 6% der Ixodes ricinus-Zecken mit dem Bakterium infiziert gefunden werden. In Tirol, im alpinen Gelände, wurden vor wenigen Jahren zwei Stämme dieses Erregers aus Ixodes ricinus isoliert. cit. Rehacek et al. [1994]. Da es sich dabei um beliebte Gegenden der Freizeitgestaltung handelt, wirft dieser Befund die Frage auf, ob durch eine Veränderung der Lebensgewohnheiten zunehmend urbaner werdender Menschen bestimmte Infektionskrankheiten die Häufigkeit ihres Auftreten- dern werden.
Die Zecken können diese weltweit auftretende Rickettsie ⇒ transovariell und ⇒ transstadial innerhalb der Zeckenpopulationen weitergeben, aber auch horizontal mittels Stich und über den Kot (Zerbeißen) auf Rinder, Pferde, Schafe, Ziegen, Hunde, Schweine (⇒ Reservoir) und den Menschen übertragen. Die Krankheit hat nach einer variablen Inkubationszeit von 3 bis 32 Tagen einen fulminanten Beginn mit hohem Fieber, Kopfschmerzen und Myalgien, hingegen fehlen meist die für Rickettsiosen typischen ⇒ petechialen ⇒ Exantheme. Die ⇒ Letalität ist trotz des heftigen Krankheitsverlaufs eher gering, chronische Verlaufsformen sind selten. Eine Chemotherapie mit Tetrazyklinen ist verfügbar.
Mediterranean Spotted Fever, Mittelmeerfleckfieber:
In Europa südlich des 45. Breitengrades und in Afrika sowie in Teilen Asiens ist das Mediterranean Spotted Fever anzutreffen. Der Erreger dieser Erkrankung ist Rickettsia conorii Brumpt, 1932. Die Braune Hundezecke, Rhipicephalus sanguineus, stellt sowohl Vektor als auch ⇒ Reservoir dar. Die klinische Symptomatik besteht aus hohem Fieber, kutanen Erscheinungen und einem nekrotischen Areal an der Inokulationsstelle der Keime (tâche noire). Letzteres ist ein je nach Region inkonstantes Symptom. Bei Diabetikern, Alkoholikern und Patienten mit kardialen Vorerkrankungen kann diese Erkrankung letal verlaufen. cit. Daxböck et al. [1999].
Mehr und mehr werden allerdings auch andere, in Europa vorkommende Rickettsia-Arten als Erreger von menschlichen Erkrankungen erkannt oder zumindest verdächtigt, der Verursacher einer solchen zu sein. Ein erwähnenswerter Fall ist jener der Rickettsia monacensis Simser et al., 2002, die erstmalig in einem Gemeinen Holzbock, Ixodes ricinus, in einem Münchner Park, dem Englischen Garten, gefunden wurde, einige Jahre später aber auch in Griechenland. Deren Potenz zur Erregung einer Krankheit beim Menschen ist bislang nicht geklärt. cit. Simser et al. [2002]; Papa et al. [2016].
Babesien-Infektionen:
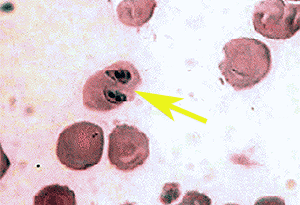
Abb. XI.7: Intraerythrozytäre Babesien. ©: unbekannt.
Babesien sind mit den Malaria-Erregern nahe verwandte Protozoen (Einzeller), also Apicomplexa. Sie leben als eine Krankheit hervorrufende Erreger in den ⇒ Erythrozyten von Säugetieren, haben meist keine präerythrozytäre Phase (Ausnahme: Babesia microti Franca, 1912 = heute: Theileria microti). Sie können - insbesondere Babesia divergens (M’Fadyean et Stockman, 1911) in Europa - bei immunologisch geschwächten Patienten und bestimmten Haustieren eine sehr schwere, manchmal tödlich endende Infektion hervorrufen. Babesien sind in Europa der zweitwichtigste Infektionserreger von Säugetieren in der Veterinärmedizin. Nur in Europa werden die meisten menschlichen Infektionen von B. divergens hervorgerufen, einem Erreger, der eine zweigipfelige saisonale Infektionshäufigkeit besitzt. cit. Zintl et al. [2003]. Der Kleinsäuger-Stamm von T. microti wird hingegen von Ixodes trianguliceps, einem Mensch-meidenden Vektor übertragen. Diese Babesienart führt in Nordamerika zu milden Infektionen bei Immunkompetenten. Erste Nachweise dieser Krankheit als autochtone (= heimische) Infektion sind aber derzeit in Diskussion; insbesondere seit nachgewiesen werden konnte, dass auch I. ricinus Babesien in einem nicht zu vernachlässigendem Ausmaß beherbergen kann. cit. Kalman et al. [2003]. Im Bild rechts ist ein mit B. canis (Piana et Galli-Valerio, 1895) befallener Erythrozyt zu sehen, auch dieser Parasit wurde mehrfach nach Österreich durch (illegale) Hundeverbringungen eingeschleppt.
Babesia canis canis wird von der Auwaldzecke (Dermacentor reticularis) übertragen. Diese Babesien-Unterart ist hoch pathogen und in ⇒ Zentraleuropa für die meisten Erkrankungen von Hunden verantwortlich. Ursprünglich kam sie nur in Nordafrika, Nord- und Mittelitalien, Frankreich und in Südungarn und Südösterreich vor. Nun finden sich auch Herde in Deutschland, der Schweiz, Holland und Polen.
Babesia canis vogeli wird von der Braunen Hundezecke (Rhipicephalus sanguineus) übertragen. Infektionen mit diesem Erreger sind in ⇒ Zentraleuropa selten und verlaufen meist mild. Verbreitet ist diese Erregerunterart in Nordafrika, dem Mittelmeerraum und in Frankreich.
Die europäische Form der Babesiose wird durch Babesia divergens hervorgerufen. In Europa nachgewiesen wurden aber auch Babesia capreoli Enigk et Friedhoff, 1962, B. bovis (Babés, 1888) und der Stamm EU-1, der in einer unklaren Erstbeschreibung den Namen B. venatorum erhielt, obgleich er möglicherweise ein Stamm der amerikanischen Art B. odocoilei ist. Das ⇒ Reservoir der Parasiten stellt in Europa für T. microti kleine Säugetiere, für B. venatorum Großwildtiere, und für B. divergens Hausrinder dar. Die Infektion mit diesem Erreger wird vor allem bei ⇒ splenektomierten Patienten klinisch manifest. Sie führt dann zu einem schweren Krankheitsbild mit einer ⇒ Mortalität von 50%. Neben uncharakteristischen Symptomen wie Fieber und Myalgien kommt es zu ⇒ hämolytischer Anämie mit Hämoglobinurie, Ikterus und Niereninsuffizienz. In manchen Fällen entwickelt sich ein Lungenödem.
Die Diagnose der Babesiose sollte sowohl bei der amerikanischen als auch bei der europäischen Form durch die Inspektion eines peripheren Blutausstrichs auf intraerythrozytäre Parasiten gestellt werden (Differentialdiagnose: Malaria!). Der Nachweis spezifischer Antikörper mittels eines Immunfluoreszenztests kann ebenfalls hilfreich sein. Dieser darf aber die Anfertigung eines Blutausstrichs nicht ersetzen, weil die spezifischen Antikörper erst zwei bis vier Wochen nach Beginn der Erkrankung signifikant ansteigen. Die Infektion mit T. microti bedarf in den meisten Fällen keiner Therapie. Ist aufgrund des klinischen Verlaufs eine antimikrobielle Behandlung indiziert, stellt für alle Formen der Babesiose eine Kombination von Chinin und Clindamycin die Therapie der Wahl dar. cit. Daxböck et al. [1999].
 Andreas R. Hassl
Andreas R. Hassl