VIII.5 Ixodes Latreille, 1795
Abb. VIII.5.1: Ein Lebensbild einer Zecke der Gattung Ixodes.
© unbekannt.
Einige Arten der Zeckengattung Ixodes sind in Österreich ⇒ autochthon und heimisch. Es handelt sich um die bei weitem am häufigsten gefundenen Arten, insbesondere die Art Ixodes ricinus, der Gemeine Holzbock, ist der Inbegriff einer Zecke in Österreich. Diese Art kann schon fast als Kulturfolger gelten, profitiert sie doch von den zahlreichen Heckenrainen und Buschwaldrändern, die im Zuge von Rekultivierungsmaßnahmen und Ackerflächenstilllegungen in den letzten Jahrzehnten angelegt wurden. Gerade das in Projekten zur nachhaltigen Bewirtschaftung wie Natura2000 festgeschrieben Verschlechterungsverbot, sowie der aus diversen Schutzprojekten resultierende Zwang zur Gestaltung abwechslungsreicher Landschaften zum Zwecke der Erbauung fördert in erheblichem Umfange die Entstehung jener Typen von Kleinbiotopen, die die Gesundheit des Menschen gefährdenden mitteleuropäischen Ixodes-Arten zum Leben benötigen. Zusammen mit der steigenden Zahl an geeigneten Wirtstieren (Haushunden, Katzen, jagdbares Wild, kulturfolgende Vogelarten) ergibt sich im passenden ⇒ Habitat ein Wirtsreservoir, das in den nächsten Jahren ein fühlbares Ansteigen von durch Ixodes übertragenen Infektionskrankheiten befürchten lässt. Dieses Szenario ist in Österreich zweifelsohne wahrscheinlicher als dasjenige, das eine lokale Klimaerwärmung für das Ansteigen von FSME-Fällen verantwortlich macht. Man kann diese These gut an Hand der Beschreibung der Situation in Schweden nachvollziehen.
Zur Benutzung der Seite eine wichtige Anmerkung: Die Taxonomie und die Namen der Tiere in der Gattung Ixodes wechseln rasch und die Darstellung eines „neuesten” Standes ist nicht zu erreichen. Zudem gibt es gravierende Gründe für die Ansicht, dass die Gattung Ixodes kein ⇒ Monophylum bildet. Insbesondere zwischen den phylogenetisch älteren, australischen Formen und den aus Afrika entstammenden und heute weltweit verbreiteten Gattungsangehörigen klafft eine deutliche Lücke. Hier in diesem Text gilt derzeit: Untergattungen innerhalb der Gattung Ixodes werden anerkannt, der Subgenus-Namen steht entsprechend der zoologischen Nomenklaturregeln in Klammer. Bei der Beschreibung der heimischen Arten wurde zwar die Artenliste von Guglielmone et al. [2010] in Bezug auf die Existenz einer Art und den validen Artnamen zu Grunde gelegt, aber die mir besser fundiert erscheinende Meinung der Experten der Fauna europaea bezüglich der Klassifikation in Untergattungen verwendet. Dies führt hier zur Verwendung des als valide angesehenen Gattungsnamens Ixodes und der Untergattungsnamen in Klammern. Konsequenterweise gibt es daher hier einen Schlüssel für die „Untergattungen”, der allerdings dann meist nicht bis auf das Artniveau führt. Zur Bestimmung auf das Artniveau wird hingegen ein stark veränderter Schlüssel nach Babos [1964] dargelegt, der im Original die Untergattungen nicht anerkennt und in vielen Fällen wenig wahrscheinliche Annahmen zu den Synonymen enthält. Für den „Hausgebrauch” sollte die hier dargelegte Nomenklatur aber in jedem Fall reichen.
Inhaltsverzeichnis:
- VIII.5.1Kurzbeschreibung der Gattung
- VIII.5.2Bestimmungsschlüssel für die Untergattungen
- ❍Subgenus Endopalpiger
- ❍Subgenus Eschatocephalus
- ❍Bestimmungstabelle für die ⇒ chiropterophagen Eschatocephalus-Arten,die in Zentraleuropa heimisch sind oder mit hoher Wahrscheinlichkeit vorkommen
- ❍Subgenus Sternalixodes
- ❍Subgenus Ixodes s. str.
- ❍Bestimmungsschlüssel für die Ixodes s. str.-Arten
- ❍Subgenus Pholeoixodes
- ❍Bestimmungsschlüssel für die mammalophagen Pholeoixodiden-Arten,die in Zentraleuropa heimisch sind oder mit hoher Wahrscheinlichkeit vorkommen
- ❍Bestimmungsschlüssel für die ornithophagen Pholeoixodiden-Arten,die in Zentraleuropa heimisch sind oder mit hoher Wahrscheinlichkeit vorkommen
- VIII.5.3Kurzbeschreibung von in Zentraleuropa nachgewiesene Ixodes-Arten,die aber in Zentraleuropa mit hoher Wahrscheinlichkeit nicht vorkommenoder sich im Falle einer Einschleppung nicht länger als ein Jahr halten können.
- VIII.5.4Einzelbeschreibung von Arten,die in Zentraleuropa heimisch sind oder mit hoher Wahrscheinlichkeit vorkommen
- ❍Ixodes acuminatus. Häufig verwendetes Synonym: Ixodes redikorzevi
- ❍Ixodes apronophorus
- ❍Ixodes (Pholeoixodes) arboricola
- ❍Ixodes (Eschatocephalus) ariadnae
- ❍Ixodes (Pholeoixodes) canisuga
- ❍Ixodes frontalis
- ❍Ixodes (Pholeoixodes) hexagonus. Manchmal verwendetes Synonym: Ixodes autumnalis
- ❍Ixodes inopinatus
- ❍Ixodes laguri . . . Vorkommen in Ostösterreich vermutet
- ❍Ixodes (Pholeoixodes) lividus
- ❍Ixodes persulcatus . . . Vorkommen in Österreich vermutet
- ❍Ixodes ricinus
- ❍Ixodes rugicollis . . . Vorkommen in Österreich wahrscheinlich
- ❍Ixodes (Eschatocephalus) simplex
- ❍Ixodes (Exopalpiger) trianguliceps
- ❍Ixodes (Eschatocephalus) vespertilionis
VIII.5.1 Kurzbeschreibung der Gattung Ixodes
- Benennung: Schildzecken - Hard Ticks - Ixodidés - garrapatas duras
- Klassifikation nach ICD-10-GM: B88.2 Sonstiger Befall durch Arthropoden
- System (Reich/Stamm/Klasse/Ordnung/Familie): Metazoa/Arthropoda/Arachnida/Ixodida/Ixodidae
- Artenzahl: Genus Ixodes: 253 Arten im Jahre 2020, in Österreich wird das Vorkommen von 16 Arten vermutet oder es ist nachgewiesen
- Charakteristik: Drei-wirtiger, temporärer, obligatorischer, häufig euryxener, telmophager, ektoparasitischer Blutsauger
- Größe: Bis 21 mm
- Status: Bedeutender Vektor, Überträger, tritt selten nur als Erreger in Erscheinung
- Übertragungsart: Beim Blutsaugen mit dem Speichel
- Entwicklung: Ein Larvenstadium, ein Nymphenstadium, getrenntgeschlechtliche Adulte
- Entwicklungsdauer: (Ei/Larve/Nymphe/Adulte): ??d/??d/bis ?m/3 Jahre, bis 5 Jahre
- Habitate in Österreich: Freilebende Arten: Feuchte Flusstäler, Waldraine; viele Arten sind allerdings Spezialisten und an den Lebensraum ihrer Wirte gebunden
Mit aktuellem Stand sind genau 253 Arten taxonomisch anerkannt, die der Gattung Ixodes angehören. Die Gattung Ixodes wird als entwicklungsgeschichtlich altes ⇒ Monophylum betrachtet, da das die Gattung kennzeichnende Merkmal, die Lage der Analfurche ⇒ kranial zum ⇒ Anus immer noch als das maßgebende, 250 Millionen Jahre alte, ⇒ autapomorphe Merkmal angesehen wird. Ixodes-Zecken gehören deshalb zu den ⇒ prostriaten Zecken. Ixodes-Arten mit sehr ursprünglichen Charakteristika haben sich bis heute in Australien und Ozeanien erhalten. Der Entstehungsort der Ixodes-Zecken könnte jedoch in Afrika gelegen haben und die noch sehr ursprünglichen Tiere dann in einer Verbreitungswelle innerhalb von Pangaea ins heutige Australien gelangt sein. Im südlichen Afrika entstanden jedoch in jedem Fall die modernen Ixodes-Formen, die dann in einer oder zwei Wellen nach Europa und Asien gelangten. Von Europa aus ging es im Erdmittelalter vermutlich mit den Wanderungen der Flugsaurier über den noch schmalen Nordatlantik nach Nordamerika. Vor etwa 30 Millionen Jahren erreichten Zecken aus der Ixodes pacificus-Gruppe Südamerika, wo sie ⇒ autochthone Arten ausbildeten, zB I. pararicinus. Je nach Ansicht des Bearbeiters über das ursprüngliche Verbreitungsgebiet der Stammform(en) entwickelte sich die Gattung Ixodes also entweder in Afrika oder in Australien. cit. Dunlop et al. [2016]. Sie ist leicht an einer Besonderheit zu erkennen: Bei Tieren dieser Gattung ist die Analfalte deutlich ausgeprägt und umfasst den ⇒ Anus ⇒ anterior, dh die Analfurche liegt vor dem Anus. Normalerweise vereinigt sie sich zu einem Punkt oder in einem Bogen. Bei einigen Arten vereinigen sich die beiden ⇒ lateral zum Anus liegenden Äste der Furche nicht, sondern beiden Äste laufen parallel zueinander und zur Längsachse des Körpers. Die Palpen sind gewöhnlich lang, diese und die Basis capituli sind von variabler Form. Festone sind nie vorhanden. Die Cuticula enthält niemals emailartige Farben, sondern die Tiere sind in den meisten Fällen habituell unattraktiv und schlicht braun, grau bis schwarz gefärbt. Den Tieren dieser Gattung fehlen Augen und Ocellen.
Bei vielen Arten sind die ⇒ Pulvilli am ersten Beinpaar auffallend vergrößert. Die ⇒ Coxen der Beine tragen häufig ein nach hinten gerichtetes Paar Dornen, einen inneren, dh näher zum Körper gelegenen, und einen äußeren. Auch am Trochanter kann ein nach hinten gerichteter Dorn sitzen. Charakteristisch für die Gattung Ixodes ist außerdem ein ausgeprägter Geschlechtsdimorphismus im Aufbau des Hypostoms. Form und Länge der ⇒ Palpen sind bei den einzelnen Arten sehr verschieden. Die ⇒ Spirakularplatten sind beim Männchen oval, jene des Weibchens kreisförmig. Die Bauchseite des Männchens ist mit sieben Platten gepanzert. Es existieren prägenitale, mediane, anale und adanale Schilder, die adanalen Schilder sind ein spiegelbildliches Paar.
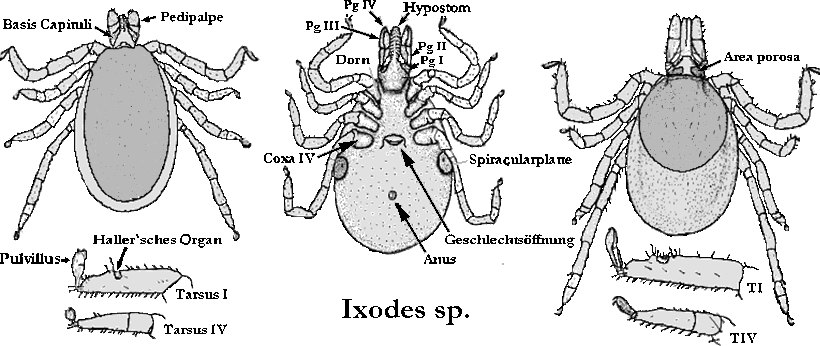
Genus-Synonyme sind Acarus Linnaeus, 1746; Cynorhaestes Hermann, 1804; Crotonus Dumeril, 1829; Haemalastor C.L.Koch, 1844; Eschatocephalus Fraunfeld, 1853; Dermanyssus Kolenati, 1856; Hyalomma Pickerd-Cambridge, 1878; Phauloixodes Berlese, 1889; Ceratoixodes Neumann, 1902; Euixodes Neumann, 1904; Sternalixodes Schulze, 1935; Subg. Exopalpiger Schulze, 1935; Subg. Endopalpiger Schulze, 1935; Subg. Lepidixodes Schulze, 1935; Pholeoixodes Schulze, 1942; Subg. Ixodes Tendeiro, 1962.
Die Tiere der Gattung Ixodes sind durchwegs drei-wirtige Schildzecken: Larven, Nymphen und Adulte saugen jeweils an verschiedenen Wirtstierindividuen und häufig auch -arten. Die langen Mundwerkzeuge der Weibchen dieser Zeckengattung führen zu erheblichen ⇒ Belästigungen der Wirtstiere beim Stich. Als Wirte dienen hauptsächlich Säugetiere und Vögel, den Larven auch Reptilien, insbesondere Eidechsen. Von den europäischen Arten parasitieren I. ricinus, I. (Pholeoixodes) canisuga und I. persulcatus gerne auch am Menschen. Die Entwicklungsdauer schwankt je nach den ⇒ trophischen Verhältnissen, dh nach der Häufigkeit von Blutmahlzeiten, zwischen zwei und fünf Jahren, im Durchschnitt sind es drei Jahre. Damit ist die Dauer des Lebenszyklus von Ixodes sp. verhältnismäßig lang verglichen mit der von Vertretern anderer Schildzeckengattungen.
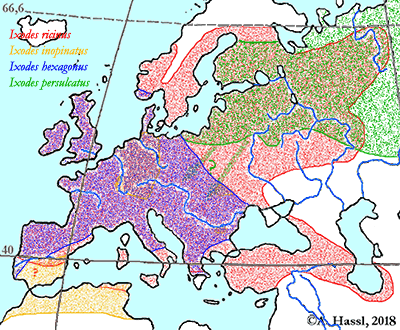
Abb. VIII.5.3: Die Verbreitung der - vermutlich - medizinisch bedeutendsten Borrelia-Übertrager in Europa. © A. Hassl.
Die meisten Arten aus der Gattung Ixodes sind in Europa weit verbreitet und ubiquitär in vielen Lebensräumen, weshalb sie auch allgemein bekannt sind und populär als Überträger von Krankheitserregern gefürchtet werden. Die Gattung Ixodes ist mit hoher Wahrscheinlichkeit ein holarktisches ⇒ Taxon, das Hitze und Trockenheit rezent nicht sehr gut verträgt. Einschränkend muss allerdings festgehalten werden, dass die urtümlichsten Vertreter der Gattung Ixodes in Australien gefunden werden - deren ⇒ Xerothermophilie ist aber meiner Meinung nach eine Eigenschaft, die auf eine Anpassung an den gegenwärtigen Lebensraum zurück zu führen ist. Eine I. ricinus mit Ausnahme der Morphologie der Coxen sehr ähnlich sehende Zecke, Ixodes succineus Weidner, 1964 wurde aus dem baltischen Bernstein beschrieben. cit. Weidner [1964]. Das Bernsteinstück stammt aus dem Obereozän, es ist also etwa 35 Mill Jahre alt. In Zentraleuropa ist I. ricinus die mit Abstand bekannteste Zecken-Art überhaupt. Dies beruht wohl darauf, dass diese Zecke der Hauptüberträger der fünf Erreger der Borreliose und des Erregers der Frühsommer-Meningoenzephalitis ist. Die europäischen Verbreitungsareale der für den Menschen wichtigsten Borrelia-Überträger und ⇒ Reservoire aus der Gattung Ixodes zeigt die Karte links. Nach einer Idee von Stanek et al. [2012], in stark veränderter Form.
VIII.5.2 Bestimmungsschlüssel für die Untergattungen
in Österreich nur eine Art bekannt • • • ➤ Ixodes (Exopalpiger) trianguliceps
Subgenus Sternalixodes P. Schulze
Der Rand des ⇒ Scutums erreicht bei nüchternen Tieren den Körperrand. Die ersten Glieder der ⇒ Palpen stehen senkrecht zur ⇒ Basis capituli. Zumindest die Nymphen, aber auch oft die Weibchen, haben eine Sternalplatte. Bei den Männchen ist der hintere Saum der Coxa behaart. Typusart ist Ixodes (Sternalixodes) cordifer Neumann, 1908. Alle bekannten Arten dieses Subgenus sind nur in Ozeanien und Australien verbreitet.
Subgenus Exopalpiger P. Schulze
Die Areae porosae sind auf der ⇒ Basis capituli in Richtung der Palpencoxen verschoben. Die Palpentrochanter sind groß, nach außen verlängert und noch nicht vollständig mit der Basis capituli verschmolzen. Zumindest an den ⇒ Coxen des ersten Beinpaares ist keine poröse Fläche zu erkennen. Die Ränder des Scutums sind mehr oder weniger gerade und verlaufen nach hinten auseinander, so dass das Scutum am hinteren Ende am breitesten ist. Typusart ist Ixodes (Exopalpiger) priscicollaris Schulze, 1932. Die meisten Arten sind in Australien und den umliegenden Inseln verbreitet, nur Ixodes (Exopalpiger) trianguliceps Birula, 1895 kommt in Zentraleuropa vor.
Subgenus Endopalpiger P. Schulze
Das zweite und das dritte Palpenglied sind verwachsen. Der Palpentrochanter ist stark von der ⇒ Basis capituli abgesondert und stark vergrößert. Er verläuft schräg nach vorne. Die ⇒ Areae porosae sind nur schwach ausgebildet und zur Seite verschoben. An den Coxen aller Beinpaare sitzt seitlich je eine deutlich zu erkennende, von Poren durchsetzte Fläche, die Area coxalis. Die vollgesogenen Weibchen sind auffallend schmal. Typusart ist Ixodes (Endopalpiger) luxuriosus Schulze, 1932. Alle Arten dieser Untergattung sind in Australien zu finden.
Subgenus Eschatocephalus Frauenfeld
In dieser Untergattung finden sich in Zentraleuropa nur drei Arten, die alle an Fledermäusen parasitieren. Davon ist eine Art, Ixodes simplex, beinahe ausschließlich nur auf Miniopterus schreibersii, der Langflügelfledermaus, zu finden. Es handelt sich also um eine Art, die sich auf dem Weg zum stationären, ⇒ monoxenen Parasiten befindet. Die beiden anderen Arten krabbeln hingegen häufig in den Fledermausunterständen oder in von Fledermäusen bewohnten Höhlen umher.
Bestimmungsschlüssel für die ⇒ chiropterophagen Eschatocephalus-Arten,
die in Zentraleuropa heimisch sind oder mit hoher Wahrscheinlichkeit vorkommen:
Bestimmungsschlüssel für die Weibchen, Männchen, Nymphen und Larven:
Bestimmungstabelle für die Weibchen der ⇒ chiropterophagen Eschatocephalus-Arten,
die in Zentraleuropa heimisch sind oder mit hoher Wahrscheinlichkeit vorkommen:
| Tab. VIII.5.1: Morphologische Merkmale zur Bestimmung von Fledermaus-assoziierten Ixodes-Weibchen | |||
|---|---|---|---|
| Ixodes (Eschatocephalus) simplex | |||
| Maximale Länge in mm, im vollgesogenen Zustand | 10 | 7 | 4,5 |
| Länge der Beine | lang (Tarsus I: 1,6 mm) | lang (Tarsus I: 1,5 mm) | mäßig lang (Tarsus I: 0,73 mm) |
| Basis capituli | dorsal postero-lateral ein hervorspringender Rand | dorsal postero-lateral ein hervorspringender Rand | dorsal kein hervorspringender Rand, ventro-lateral ein dreieckiger, hervorstehender Grat |
| posterior gerade | posterior leicht gebogen mit einem dorsalen Grat | posterior krumm | |
| Palpen (II. & III. Segment) | lang, schmal (0,39 & 0,22 mm) | kurz, breit (0,28 & 0,16) | kurz (0,16 & 0,14 mm) |
| Verbindung des zweiten zum dritten Segment | ausgeprägt | ausgeprägt | verschwommen |
| Hypostom | lang, 15 Querreihen schlanker Zähne, ventral in 6 bis 8 Spalten (3-3 bis 4-4) | mittellang, 10 Querreihen breiter Zähne, ventral in 4 Spalten (2-2) | kurz, 8 Querreihen breiter Zähne, ventral in 4 bis 6 Spalten (2-2 bis 3-3) |
| Areae porosae | ausgedehnt, oval, der Abstand weit | ausgedehnt, oval, Abstand mittelbreit | ausgedehnt, oval, Abstand schmal |
| Schild: Setae | antero-lateral dicht | antero-lateral sehr wenige | antero-lateral dicht |
| Schild: Länge zu Breite | 1,76 bis 1,08; ∅ 1,6 | 1,15 bis 0,95; ∅ 1,2 | 1,13 bis 0,8; ∅ 1,4 |
| Borstenbedeckung am Idiosoma | dicht | spärlich | dicht |
| Coxen | postero-extern konkav, flache Oberfläche | postero-extern konvex, abgerundete Oberfläche | postero-extern konkav |
| Analfalte | parallel | posterior leicht divergierend | posterior deutlich divergierend |
| Spirakularöffnungen | oval, regelmäßige Umrisslinie | oval, unregelmäßige Umrisslinie | (sub)ringförmig, breit |
Subgenus Pholeoixodes P. Schulze
Zecken dieser Untergattung schmarotzen an höhlenbewohnenden Säugern (Fledermäusen) und Vögeln. Die vom Körper weiter entfernt liegenden Enden der Tarsi verschmälern sich jäh. Kurz vor der Verschmälerung befinden sich kleine Höcker. Normalerweise tragen die Coxen keine Dornen. Bei den Männchen sind die Zähne am Hypostom nur noch rudimentär vorhanden und zu zackigen bis welligen Kämmen verbunden. Das rudimentäre Hypostom des Männchens ist ein typisches Kennzeichen von Pholeoixodes. Bei vielen der Arten sind die Männchen aber unbekannt, da sie seltener an Wirtstieren saugend vorgefunden werden.
Das ⇒ Capitulum ist kurz; das Breite-Längen-Verhältnis des zweiten zum dritten Palpalabschnitts bei den Larven, Nymphen und Weibchen wie 1:(2,0 bis 2,5). Die ⇒ Palpen sind keulenförmig, im Umriss mehr ⇒ konvex auf der unteren Innenseite. Der dorsal gelegene Teil der ⇒ Basis capituli ist bei den Weibchen, Nymphen und Larven im Umriss dreieckig, bei den Männchen in der Form eines Trapezes. Die Hypostomzähne sind bei den Männchen stark reduziert. Die Beine sind von normaler Länge, die Tarsen vermindern ihren Durchmesser nach distal mit einer starken Verengung auf der Außenseite des Haller`schen Organs.
Larvale ⇒ Chaetotaxie am ⇒ Idiosoma: Anzahl der Borstenhaare (⇒ Setae): Skutale Setae (S) 5 Paare (P), zentral-dorsale S 2 P, randständig dorsale S 7-9 P, sternale S 3 P, präanale S 2 P, paraanale S 3 P, anale S 1 P, epimerale S 5 P. cit. Siuda et al. [2010].
Die Arten dieser Untergattung kommen vor allem in Europa vor. Die Taxonomie und damit die Identifizierung der Tiere innerhalb dieser Untergattung ist unsicher und sich laufend ändernd. Vermutlich handelt es sich um eine gerade in rascher Radiation begriffene Gruppe. Der untere Bestimmungsschlüssel ist nur für die Weibchen:
Bestimmungsschlüssel für die mammalophilen Pholeoixodiden-Arten,
die in Zentraleuropa heimisch sind oder mit hoher Wahrscheinlichkeit vorkommen:
Bestimmungsschlüssel für die Weibchen:
Bestimmungsschlüssel für ornithophilen Pholeoixodiden-Arten,
die in Zentraleuropa heimisch sind oder mit hoher Wahrscheinlichkeit vorkommen:
Bestimmungsschlüssel für die Weibchen:
Subgenus Ixodes s. str. Latreille
Die Ixodes s. str.-Arten (etwa 80) tragen die „typischen” Ixodes-Merkmale: Eine Sternalplatte fehlt. Die Palpentrochanter sind mit der Basis capituli verwachsen. Die Beine sind nicht auffallend lang und die Coxen tragen in den meisten Fällen zumindest einen Dorn. Das Hypostom des Männchens ist mit Zähnen versehen. Es finden sich keine Höhlen-besiedelnde Formen. I. ricinus bildet allerdings einen Artenkomplex, zu dem etwa vierzehn Formen (Arten) mit weltweiter Verbreitung gehören, so zB I. scapularis, I. persulcatus und I. pacificus. Die Abgrenzung des Artkomplexes beruht hauptsächlich auf seiner Funktion als ⇒ Vektor für Borrelien, neuere Studien zeigen, dass der Artkomplex wahrscheinlich ⇒ paraphyletisch ist. Die Fähigkeit, ein guter Spirochätenvektor zu sein, ist zumindest mit I. persulcatus - nun nicht mehr in den Artenkomplex gehörend - ein weiteres Mal unabhängig entstanden. cit. Xu et al. [2003].
Bestimmungsschlüssel für die Ixodes s. str.-Arten
die in Zentraleuropa heimisch sind oder mit hoher Wahrscheinlichkeit vorkommen:
Bestimmungsschlüssel für die Weibchen:
Bestimmungsschlüssel für die Männchen:
Bestimmungsschlüssel für die Nymphen
Bestimmungsschlüssel für die Larven:
VIII.5.3 Kurzbeschreibung von in Zentraleuropa nachgewiesenen Ixodes-Arten, die aber in Zentraleuropa mit hoher Wahrscheinlichkeit nicht vorkommen oder sich im Falle einer Einschleppung nicht länger als ein Jahr halten können.
Ixodes caledonicus Nuttall, 1910; dt: Nördliche Vogelzecke
Ixodes caledonicus kann in allen Stadien von der am nächsten verwandten Art, I. berlesei, unterschieden werden. Der Fund von Tieren dieser Art wurde aus Großbritannien, Schweden, Deutschland, Polen, der Ukraine, der Krim, aus Aserbaidschan umd aus Tadschikistan gemeldet. In Europa ist diese Art allerdings wahrscheinlich nur in Gebieten verbreitet, die nicht weiter südlich als die Ostseeküste liegen. Diese Art gehört zu einem Typus, der als Nest- oder Nisthöhlen-Parasit bezeichnet werden kann, obgleich die Tiere in Gesteinsspalten unter und neben den Vogelnestern leben. Sie kommt an Küsten und in Berg- und Hochregionen vor. Als Wirte dienen Vögel, die auf Felsen nisten. Tiere dieser Art werden durch Seevögel, die in Österreich Irrläufer sind, nachweislich verschleppt.
Ixodes (Pholeoixodes) crenulatus Koch, 1844 en: burrow tick
Es ist immer wieder bezweifelt worden, dass es sich bei Ixodes crenulatus um eine gute Art handelt. Emel’yanova zieht 1979 den Schluss, dass diese Zeckenspezies ein Artenkomplex ist; diese Annahme basiert auf bestimmten ⇒ morphologischen und ⇒ ökologischen Eigenschaften dieser Zecke. Dabei wurde I. crenulatus anscheinend auf Grund eines Fundes in Deutschland erstbeschrieben. cit. Koch [1844]. Es wurde aber immer bezweifelt, dass diese angeblich generalistische Zecke in Deutschland überhaupt ⇒ autochthon vorkommt. Deshalb halten Sonenshine et al. [1969] I. crenulatus für ein Synonym von I. kaiseri. Dagegen sprechen sich allerdings - mich überzeugend - Filippova et Uspenskaia [1973] aus. Überzeugend deswegen, weil I. kaiseri unbestreitbar ein Vogelspezialist ist und vermutlich in keiner Situation Säugetiere als Blutspender akzeptiert und/oder zum Zwecke des Blutsaugens befällt. Es existieren verstreut diverse Literaturstellen zu dieser Zecken-Art, die aber nicht kompatibel sind. So wird zB in einem Zitat behauptet, dass I. crenulatus in Zypern ein kulturfolgender Haustierparasit ist. Filippova et Panova [2000] postulieren die Existenz von vier Morphotypen innerhalb dieser Art, deren eine in Zentraleuropa alpin verbreitet sein soll und möglicherweise eine unterschiedliche Bionomie zu den anderen Typen besitzt. Ich habe mich dazu entschlossen der Vorgabe von Babos [1964] zu folgen. Zwar unterstütze ich die mir am meisten konsistent erscheinenden Auffassung der Existenz einer eigenständigen, ⇒ mammalophagen und in Österreich vorkommenden Morphotype, die ich mit dem Namen einer guten Art, I. crenulatus, bezeichne. Ich gehe davon aus, dass I. crenulatus in Zentraleuropa rezent ein Eiszeitrelikt ist, und zwar ist dieses Taxon lokal ein erzwungenermaßen alpiner, höchstwahrscheinlich ⇒ nidikoler Spezialist mit den Wirten Alpenmurmeltier und kleine Raubsäuger. Allerdings gibt es keine in Europa verfügbare Literatur zum Aussehen dieser Zecke oder der in Europa vorkommenden Morphotype. Somit ist eine Abgrenzung zu anderen Ixodes-Arten derzeit nicht möglich. Wegen dieser Schwierigkeiten im empirischen Umgang mit dieser Zecke wird diese Zecken-Art hier unter dem Status „in Österreich nicht vorkommend” geführt. Folgt man der von mir dargelegten Auffassung zur Existenz der Art, so ergeben sich allerdings andere Synonyme als die im Standardwerk von Guglielmone et Nava angeführten. cit. Guglielmone et Nava [2014].
Synonyme:
I. hexagonus Leach, 1815;
I. canisuga Johnston, 1849;
I. crenulatus Clifford et Anastos, 1960;
I. lividus crenulatus Yav´ya, Igolkin et Fedorov, 1960;
I. crenulatus terecus Marutyan, 1963;
Pholeoixodes crenulatus Morel et Pérez, 1973;
I. prokopyevi Emel´yanova, 1979.
 Adulte und Subadulte: Von dieser Art ist derzeit keine Beschreibung ihrer Morphologie und des Habitus verfügbar. Ein Lebendbild dieser Zecke wurde zwar gefunden - betrachtet man dieses aber genauer, so kann dieses nicht als Nachweis der Eigenständigkeit dieser Zecken-Art genutzt werden. Nach einer vermutlich veralteten Auffassung soll es sich um eine weitverbreitete, ⇒ nidikole und ⇒ kavernikole Zecken-Art handeln, mit einem breiten mammalen und aviden Wirtsspektrum. Eine rezentere Meinung, der ich mich anschließe, ist, dass es sich um einen Nahrungsspezialisten handelt. Die Männchen saugen wahrscheinlich gar nicht (mehr).
Adulte und Subadulte: Von dieser Art ist derzeit keine Beschreibung ihrer Morphologie und des Habitus verfügbar. Ein Lebendbild dieser Zecke wurde zwar gefunden - betrachtet man dieses aber genauer, so kann dieses nicht als Nachweis der Eigenständigkeit dieser Zecken-Art genutzt werden. Nach einer vermutlich veralteten Auffassung soll es sich um eine weitverbreitete, ⇒ nidikole und ⇒ kavernikole Zecken-Art handeln, mit einem breiten mammalen und aviden Wirtsspektrum. Eine rezentere Meinung, der ich mich anschließe, ist, dass es sich um einen Nahrungsspezialisten handelt. Die Männchen saugen wahrscheinlich gar nicht (mehr).
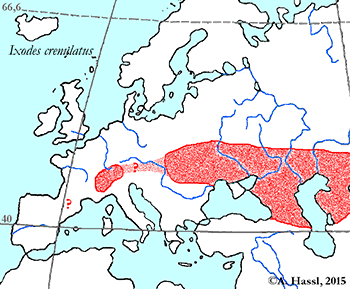 Verbreitung & Bionomie: Folgt man der vermutlich veralteten, chaotischen Auffassung, dass diese Art ein Generalist mit breitem, jedoch undefiniertem Wirtsspektrum ist und/oder dass es sich um ein Synonym von I. hexagonus oder um eines von I. canisuga handelt, so ergeben sich folgende Aspekte zur Verbreitung: Das Verbreitungsgebiet von I. crenulatus erstreckt sich in Europa von Irland im Westen, Dänemark im Norden und Spanien, Italien und dem Balken im Süden über alle Höhenlagen und natürlichen Lebensräume Zentraleuropas. Von hier reicht es dann durchgehend bis nach Afghanistan, Indien, der Inneren Mongolei und China. Einerseits wird von einigen Kundigen eine ⇒ nidikole oder ⇒ kavernikole Lebensweise behauptet, andererseits meinen andere, dass diese Art einer ⇒ bimodalen Kurve der jahreszeitlichen Aktivität folgt. Die Hauptaktivitätszeit soll im Frühjahr im April, und im Herbst im September und Oktober sein. Merkwürdig ist allerdings, dass alle saugenden Stadien, dh Larven, Nymphen und Weibchen, dem gleichen ⇒ Aktivitätsmuster folgen sollen. Ist diese Beobachtung korrekt, kann es sich nur um eine Winter- und um eine Sommerruhe handeln. In diesem Falle wäre der Nachweis erbracht, dass es sich entweder um eine frei-lebende Art handelt oder um einen Extremspezialisten mit nur einer einzigen, ⇒ bimodal verfügbaren Wirtstierart. Unklar ist zudem, wie unter der Annahme eines breiten Wirtsspektrums von mobilen Tieren die nicht-saugenden Männchen ihre saugenden Weibchen zum Zwecke der Kopulation finden.
Verbreitung & Bionomie: Folgt man der vermutlich veralteten, chaotischen Auffassung, dass diese Art ein Generalist mit breitem, jedoch undefiniertem Wirtsspektrum ist und/oder dass es sich um ein Synonym von I. hexagonus oder um eines von I. canisuga handelt, so ergeben sich folgende Aspekte zur Verbreitung: Das Verbreitungsgebiet von I. crenulatus erstreckt sich in Europa von Irland im Westen, Dänemark im Norden und Spanien, Italien und dem Balken im Süden über alle Höhenlagen und natürlichen Lebensräume Zentraleuropas. Von hier reicht es dann durchgehend bis nach Afghanistan, Indien, der Inneren Mongolei und China. Einerseits wird von einigen Kundigen eine ⇒ nidikole oder ⇒ kavernikole Lebensweise behauptet, andererseits meinen andere, dass diese Art einer ⇒ bimodalen Kurve der jahreszeitlichen Aktivität folgt. Die Hauptaktivitätszeit soll im Frühjahr im April, und im Herbst im September und Oktober sein. Merkwürdig ist allerdings, dass alle saugenden Stadien, dh Larven, Nymphen und Weibchen, dem gleichen ⇒ Aktivitätsmuster folgen sollen. Ist diese Beobachtung korrekt, kann es sich nur um eine Winter- und um eine Sommerruhe handeln. In diesem Falle wäre der Nachweis erbracht, dass es sich entweder um eine frei-lebende Art handelt oder um einen Extremspezialisten mit nur einer einzigen, ⇒ bimodal verfügbaren Wirtstierart. Unklar ist zudem, wie unter der Annahme eines breiten Wirtsspektrums von mobilen Tieren die nicht-saugenden Männchen ihre saugenden Weibchen zum Zwecke der Kopulation finden.
Konsistenter erscheint mir aber die Annahme, dass es sich um eine Reliktart aus der (letzten) Eiszeit handelt, die ein kavernikoler Spezialist für das Blutsaugen an steppenlebenden Nagetieren, insbesondere an den heutigen Murmeltieren ist. Unter dieser Annahme besiedelt diese Zecke in Zentraleuropa nur mehr ein kleines und zersplittertes Areal in den alpinen Lagen der Alpen, nämlich jenes Gebiet in dem ihr Hauptwirt, das Alpenmurmeltier Marmota marmota, vorkommt. Das Alpenmurmeltier ist ein typischer Vertreter der eiszeitlichen Tierwelt Europas, heute eine Reliktart. Diese Art kam während des Pleistozäns auch im europäischen Tiefland vor und ist heute auf alpine Lagen beschränkt. Eine andere, mich wenig überzeugende Ansicht ist, dass die Gruppe der Murmeltiere in Nordamerika entstanden ist und postglazial in mindestens 14 Arten zerfallen ist, von denen einige in 12 000 Jahren Asien und Europa besiedelt haben und eine Art, das Alpenmurmeltier, in dieser Zeit bis in die Pyrenäen vorgestoßen ist. Ich glaube, dass das Alpenmurmeltier in den Ostalpen, also in Österreich, vermutlich eine ⇒ allochthone Spezies ist. Ihr heutiges, durchaus lokal recht dichtes Vorkommen ist vermutlich gänzlich auf Auswilderungen durch Jagdausübungsberechtigte zurückzuführen, wobei über die Zeitpunkte der Aussetzungen keine Angaben gemacht werden können. Es ist nicht bekannt, ob I. crenulatus mit den Murmeltieren verschleppt wurde, oder aber ob lokal ⇒ autochthone Restvorkommen der Zecke alleine oder auch der Murmeltiere mit Zecken bestehen. Falls, was wahrscheinlich ist, neben dem Alpenmurmeltier auch das Steppenmurmeltier, Marmota bobak, befallen werden kann, kommt die Zecken-Art in den Alpen, im Kaukasus und in den Steppen im osteuropäischen Russland, in Weißrussland, in der Ukraine sowie in Nord- und Zentralkasachstan vor. Über ein Vorkommen dieser Zecke in den vermutlich ebenfalls ⇒ anthropogen entstandenen Murmeltierkolonien der Pyrenäen gibt es keine Daten. Unter diesen Annahmen kann man weiter folgern, dass auch das Steppenmurmeltier oder der gemeinsame Vorfahre während der letzten Eiszeiten weitgehend kavernikol lebte. Wahrscheinlich hat das Steppenmurmeltier in den Blütezeiten des biozidfreien Getreideanbaus eine Verbreitungsausdehnung erfahren, vielleicht vor der Einwanderung des konkurrenzstärkeren Feldhamsters. Die Annahme, dass auch die baujagenden mammalen Fressfeinde der Murmeltiere von dieser Zecke attackiert werden, erscheint mir vertretbar zu sein, vielleicht auch noch die des Überwechselns auf Raubvögel. Es gibt ein paar nicht schlüssige Angaben zum Zeitraum der Aktivität im Jahresverlauf. Die Aktivität, genauer das Auffinden der blutsaugenden Stadien, reicht von März bis Oktober durchgehend, wobei in jedem Monat Larven, Nymphen und Weibchen gleichzeitig und am gleichen Ort gefunden werden. Die Hauptaktivitätszeit ist zweigipfelig, im Frühjahr im April, und im Herbst im September und Oktober. Über den Verbleib der Zecken im Zeitraum November bis Februar gibt es keinerlei Angaben.
 Wirte aller Stadien: Als bedeutendster Wirt: Murmeltiere, zudem noch Marder- und Hundeartige.
Wirte aller Stadien: Als bedeutendster Wirt: Murmeltiere, zudem noch Marder- und Hundeartige.
- Heimische Wirte:
- Carnivora: Canis lupus familiaris (Linnaeus, 1758) dt: Haushund;
- Vulpes vulpes (Linnaeus, 1758) dt: Rotfuchs;
- Mustela putorius Linnaeus, 1758 dt: Europäischer Iltis cit. Williams et Thompson [1991];
- Meles meles (Linnaeus, 1758) dt: Europäischer Dachs.
- Eulipotyphla: Erinaceus europaeus Linnaeus, 1758 dt: Braunbrustigel;
- Erinaceus roumanicus Barrett-Hamilton, 1900 dt: Nördlicher Weißbrustigel.
- Rodentia: Marmota marmota (Linnaeus, 1758) dt: Alpenmurmeltier (Bild rechts);
- Cricetus cricetus (Linnaeus, 1758) dt: Feldhamster.
Vektorfunktion: I. crenulatus kann den Erreger des Q-Fiebers (Coxiella burnetii (Derrick, 1939)) beherbergen, cit. Williams et Thompson [1991], und scheint in einigen Gegenden in den sylvatischen Zyklus der Russischen Frühling-Sommer-Enzephalitis (RSSE) einbezogen zu sein.
Ixodes (Pholeoixodes) filippovae Černŷ, 1961
Falls es sich um eine gute ⇒ biologische Art handelt, vermutlich in Österreich nicht vorkommend. Als Synonyme werden allerdings I. crenulatus (Pomerantzev, 1950), Ixodes danyi (Babos, 1964) und I. vulpis (Babos, 1964) angegeben. Diese Vielfalt in der Bionomie der als Synonyme geltenden Tiere macht eine Abgrenzung der Art zu den „Synonymen”, falls diese selbst gute Arten sein sollten, beinahe unmöglich.
Ixodes (Pholeoixodes) kaiseri Arthur, 1957; en: Egyptian Fox Cub Russet Tick
Das nordwestlichste, gesicherte Vorkommen dieser Ixodes-Art liegt in Rumänien, angeblich gibt es auch einen Fundpunkt in der ehemaligen CSSR. Diese Fundort-Angabe ist aber biogeographisch problematisch und wird von mir in ihrer Richtigkeit bezweifelt. Dies deshalb, weil ich Ixodes (Pholeoixodes) kaiseri für eine gute biologische, wahrscheinlich mediterrane oder pannonische Art mit einer Spezialisierung auf Kleinräubsäuger halte. ⇒ Ökologisch und partiell topographisch überlappt diese Art mit I. crenulatus, die ich ihrerseits aber ebenfalls für eine gute Art halte - ob diese heimisch ist, ist aber fraglich. Das angeblich fragmentierte Verbreitungsareal von I. (Pholeoixodes) kaiseri ist schwierig zu erklären. Entweder es fehlen fundamentale Daten zur Verbreitung, oder es handelt sich um eine Art am biogeographischen Rückzug, oder aber die Art ist ein verschleppbarer Vogelparasit.
Ixodes unicavatus Neumann, 1908
Parasitiert nur auf fischfressenden Vögeln, möglicherweise ausschließlich auf Kormoranen. Dann ist diese Art wohl ein ⇒ nidikoler Spezialist. Das geschlossenes Verbreitungsgebiet umfasst Schottland, England und die gegenüberliegende französische Kanalküste, nicht aber Irland! Einzelfunde auch in Schweden und auf der Krim. Falls es sich um einen Kormorannest-Bewohner handelt, ist das fast völlige Ausrotten dieser Vögel in ⇒ Zentraleuropa eine stichhaltige Erklärung für das zersplitterte Vorkommen.
Ixodes uriae White, 1852
Nur in den Nestern von marinen Vögeln zu finden. Auf der Nordhalbkugel nicht weiter südlich als die Bretagne. Zirkumpolares Vorkommen auf der Nordhalbkugel, Funde auch auf der Südhalbkugel, zB in Australien. cit. Barker et al. [2014]. Diese Art lebt in den Kolonien von Seevögeln, sie ist also ⇒ nidikol. Die Hauptwirte sind in der nördlichen Hemisphäre Vögel aus der Familie Alcidae, das sind die Trottellummen. In der südlichen Hemisphäre werden auch Albatrosse, Sturmvögel und Pinguine parasitiert. Mehr als 50 Vogelarten sind als Wirte nachgewiesen, darunter auch heimische Arten oder Gäste wie Kormorane, Möwen und Sturmvögel. Diese Zecken-Art ist ein Vektor für viele ARBO-Viren, die Seevögel infizieren. In Massen parasitierende Zecken führen zu ⇒ Intoxikationen der Vögel.
Ixodes ventalloi Gill Collado, 1936; dt: Kaninchenzecke
Einige vermuten eine ⇒ kavernikole Art, die dann ein Spezialist an Kaninchen ist (Name!). Andere meinen jedoch, dass es sich bei dieser Art um einen, wohl frei-lebenden, Generalisten an Säugetieren mit einem bloßen Vorzugswirt im Adultstadium handelt. Diese Art konnte jedoch bislang nicht weiter östlich als im Elsass gefunden werden. In Österreich gibt es vermutlich (auch) zu geringe Kaninchenbestände, um dieser Zecken-Art, falls es sich doch um einen Spezialisten handeln sollte, eine Existenzgrundlage zu bieten.
VIII.5.4 Einzelbeschreibung von Arten, die in Zentraleuropa heimisch sind oder mit hoher Wahrscheinlichkeit vorkommen
Ixodes acuminatus Neumann, 1901
dt: Südliche Nagetierzecke
Die Abgrenzung dieser Art von anderen Ixodes-Arten und die Synonymisierung mit Ixodes redikorzevi sind heftig umstritten. Es wird hier der mir am meisten konsequent erscheinenden Ansicht gefolgt und einer Synonymisierung stattgegeben - unter der Annahme, dass die Beschreibung von „redikorzevi” selbst richtig und fehlerfrei ist. Angehörige der Subspezies I. redikorzevi laguri (oder lagurae) gehören aber in jedem Fall zur Art Ixodes laguri. Durch die Zugrundelegung dieser Ansicht, die von (ehemals) westlich orientierten Forschern bevorzugt wird, sind kaum verlässliche bionomische Angaben zu dieser Zecken-Art zu finden.
Synonyme:
I. theodori Warburton 1927;
I. redikorzevi Olenev, 1927;
I. dorriensmithi Turk, 1948;
I. guernseyensis Arthur 1955.
Weibchen: 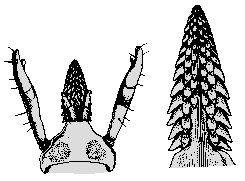 Der Körper ist länglichoval, zum ⇒ Capitulum hin verjüngt, im nüchternen Zustand 2,2-2,5 mm lang, angesogen bis 6 mm.
Der Körper ist länglichoval, zum ⇒ Capitulum hin verjüngt, im nüchternen Zustand 2,2-2,5 mm lang, angesogen bis 6 mm.  Das Hypostom ist stilettförmig ausgebildet; es ist auf der ⇒ Ventralseite außen mit zwei Zahnlängsreihen besetzt; nach innen folgen vier Zahnreihen, wovon die beiden innersten jedoch erst im zweiten Drittel angesetzt sind. An der Basis des Hypostoms sind ventral wie bei anderen Zecken-Arten zwei Poren ausgebildet Wie das Hypostom sind auch die ⇒ Chelizeren zweiseitig symmetrisch. Der Chelizerenschaft ist entlang der Innenseite mit in Reihen angeordneten kleinen Widerhaken besetzt. Die Schneideblätter sind mit fünf bis sechs verschieden großen Haken besetzt. An der Spitze des Chelizerenendgliedes liegen in einer Längsreihe acht kleine Widerhaken. Das ⇒ apikale, vorletzte Palpalglied hat einen daumenförmigen Fortsatz, der an der Basis des Palpentarsus zu den Chelizeren hin gerichtet ist. Am Grund des Palpalendgliedes liegen acht spitz endende Dornen; in der Mitte inserieren elf am Ende abgerundete und verschieden lange Sensillen. Diese sind an der Spitze wahrscheinlich porös.
Das Hypostom ist stilettförmig ausgebildet; es ist auf der ⇒ Ventralseite außen mit zwei Zahnlängsreihen besetzt; nach innen folgen vier Zahnreihen, wovon die beiden innersten jedoch erst im zweiten Drittel angesetzt sind. An der Basis des Hypostoms sind ventral wie bei anderen Zecken-Arten zwei Poren ausgebildet Wie das Hypostom sind auch die ⇒ Chelizeren zweiseitig symmetrisch. Der Chelizerenschaft ist entlang der Innenseite mit in Reihen angeordneten kleinen Widerhaken besetzt. Die Schneideblätter sind mit fünf bis sechs verschieden großen Haken besetzt. An der Spitze des Chelizerenendgliedes liegen in einer Längsreihe acht kleine Widerhaken. Das ⇒ apikale, vorletzte Palpalglied hat einen daumenförmigen Fortsatz, der an der Basis des Palpentarsus zu den Chelizeren hin gerichtet ist. Am Grund des Palpalendgliedes liegen acht spitz endende Dornen; in der Mitte inserieren elf am Ende abgerundete und verschieden lange Sensillen. Diese sind an der Spitze wahrscheinlich porös.
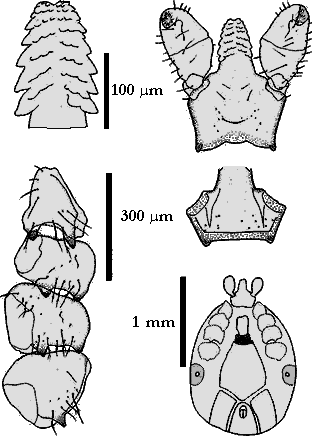
Die Umrisse der Areae porosae sind rund oder bohnenförmig. Die 80 bis 100 Poren durchbrechen das ⇒ Capitulum, welches in fünfeckige und sechseckige Strukturen aufgegliedert ist. Das Rückenschild ist langgestreckt, oval und deutlich mit Poren durchsetzt. Die einzelnen Schildhaare werden wohl deshalb als unregelmäßig angeordnet beschrieben, weil sie leicht an der Basis abbrechen. Zur Spitze hin sind sie etwas aufgefächert. Die ⇒ Coxen weisen Außen- und Innendornen auf; der Innendorn der Coxen des ersten Beinpaares ist am längsten. Er wird bei den Coxen der anderen Beinpaare immer kleiner und ist bei der Coxa des vierten Beinpaares nur mehr angedeutet. Die Außendornen sind nahezu alle gleich groß ausgebildet.
Die ⇒ Genitalöffnung liegt auf der Höhe der Coxen des vierten Beinpaares. Die Genitalfurche beginnt waagrecht und verläuft im rechten Winkel abdominalwärts. Die beiden Analplatten sind mit je drei Haaren besetzt und von einem Chitinring umgeben. Die Oberfläche der Platten und die des Ringes zeigen eine Fünfeck- und Sechseck-förmige Feinstruktur. Die Stigmen sind rund stark mit Poren durchsetzt. Die Macula liegt etwas aus dem Zentrum gerückt. Die Maculaspalte ist beinahe kreisrund. Sie ist von drei bis fünf Porenreihen umgeben, von denen die äußerste mehr Öffnungen aber mit kleinerem Durchmesser hat, als die innen gelegenen. Das Haller`sche Organ besteht aus einer Grube und einer Mulde. In der Grube, die bis auf eine ovale Öffnung verschlossen ist, liegen Sinneshaare. In der Mulde inserieren sechs Sensillen, die verschieden lang ausgebildet sind. Der Tarsus des ersten Beinpaares ist konisch zulaufend. Verändert cit. Sixl et al. [1972].
 Männchen: Der Körper des Männchens ist braun, glänzend und länglich oval, hinter der Mitte am breitesten. Die Abbildung linker Hand cit. Beaucournu et Robert [1965]. Der Rücken des Männchens ist spärlich mit hellen glänzenden Borstenhaaren (⇒ Setae) besetzt. Die ⇒ Cornua an der ⇒ Basis capituli sind gut entwickelt. Auf dem Hypostom sitzen sieben bis acht Querreihen Zähne, die Seitenzähne sind schwach ausgebildet. Alle Beincoxen besitzen einen Außen- und einen Innendorn. Die Borstenhaare (Setae) an den Beinen sind auffallend lang.
Männchen: Der Körper des Männchens ist braun, glänzend und länglich oval, hinter der Mitte am breitesten. Die Abbildung linker Hand cit. Beaucournu et Robert [1965]. Der Rücken des Männchens ist spärlich mit hellen glänzenden Borstenhaaren (⇒ Setae) besetzt. Die ⇒ Cornua an der ⇒ Basis capituli sind gut entwickelt. Auf dem Hypostom sitzen sieben bis acht Querreihen Zähne, die Seitenzähne sind schwach ausgebildet. Alle Beincoxen besitzen einen Außen- und einen Innendorn. Die Borstenhaare (Setae) an den Beinen sind auffallend lang.
Nymphe: Das Schild ist länger als es breit ist. Die ⇒ Basis capituli besitzt gut entwickelte ⇒ Cornua. Die Zähne auf dem ⇒ Hypostom sind in zwei Doppelreihen angeordnet. Die ⇒ Palpen sind auf der Außenseite einwärts gewölbt, auf der Innenseite nach außen gewölbt. Alle Beincoxen tragen einen Außendorn und auch einen Innendorn. Am ersten Beinpaar sind die beiden Dorne gleichgroß, bei den anderen sind die Außendorne etwas größer.
 Larve: Das Scutum ist breiter als es lang ist. Das Hypostom ist ungefähr in der Mitte am breitesten. Die Zähne stehen in acht Querreihen, die Zahnformel lautet 2-2. Die Coxen des ersten Beinpaares besitzt einen kleinen Innendorn. Alle Coxen tragen außerdem einen Außendorn.
Larve: Das Scutum ist breiter als es lang ist. Das Hypostom ist ungefähr in der Mitte am breitesten. Die Zähne stehen in acht Querreihen, die Zahnformel lautet 2-2. Die Coxen des ersten Beinpaares besitzt einen kleinen Innendorn. Alle Coxen tragen außerdem einen Außendorn.
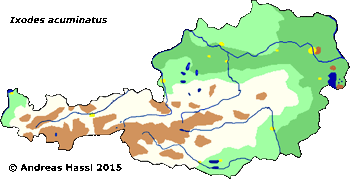
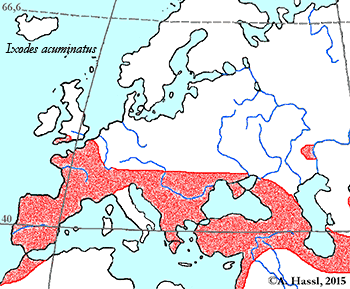 Verbreitung & Bionomie: Zecken dieser Art sind weitgehend an Nagetiere als Wirte gebunden, also Spezialisten. Sie wurden bisher in Südwest-England, den Kanalinseln, Belgien, Frankreich, Spanien, Italien, Sachsen, Ungarn, Türkei, auf der Krim, in Österreich (cit. Sixl et al. [1972]) und, ohne nähere Angaben, im Mediterranen Raum gefunden. Über die Biologie der Art ist nur bekannt, dass sie hauptsächlich in den Bauten der Wirte verharrt, sie ist also ⇒ nidikol. Vielleicht ist diese Art ein pontisches Faunenelement mit einer Assoziation zum Feldhamster und mit diesem dann ein Kulturfolger des Getreideanbaus. In Österreich wurden alle Stadien diese Art - I. redikorzevi genannt - in der Umgebung von Wien, in Parndorf, in Apetlon und im Nordburgenland nachgewiesen. Bevorzugte Areale zum Stechen sind die Augenlider, die Achselhöhlen, die Genitalregion und der Rücken der Wirte. Die Adulten sind vom Mai bis zum Oktober und die Larven und die Nymphen von Juli bis in den Oktober zu finden.
Verbreitung & Bionomie: Zecken dieser Art sind weitgehend an Nagetiere als Wirte gebunden, also Spezialisten. Sie wurden bisher in Südwest-England, den Kanalinseln, Belgien, Frankreich, Spanien, Italien, Sachsen, Ungarn, Türkei, auf der Krim, in Österreich (cit. Sixl et al. [1972]) und, ohne nähere Angaben, im Mediterranen Raum gefunden. Über die Biologie der Art ist nur bekannt, dass sie hauptsächlich in den Bauten der Wirte verharrt, sie ist also ⇒ nidikol. Vielleicht ist diese Art ein pontisches Faunenelement mit einer Assoziation zum Feldhamster und mit diesem dann ein Kulturfolger des Getreideanbaus. In Österreich wurden alle Stadien diese Art - I. redikorzevi genannt - in der Umgebung von Wien, in Parndorf, in Apetlon und im Nordburgenland nachgewiesen. Bevorzugte Areale zum Stechen sind die Augenlider, die Achselhöhlen, die Genitalregion und der Rücken der Wirte. Die Adulten sind vom Mai bis zum Oktober und die Larven und die Nymphen von Juli bis in den Oktober zu finden.
Wirte aller Stadien: Vermutlich werden höhlenbewohnende Nagetiere der Steppe als Wirte bevorzugt. Angeblich kann auch der Fuchs und der Dachs als für die Zecke gedeihliche Wirte genutzt werden. Erst unter dieser Annahme kann die Verbreitung der Zecke in England erklärt werden. Diese Zecke attackiert selten, aber doch auch den Menschen. cit. Bursali et al. [2010] und Bursali et al. [2013].
- Heimische Wirte:
- Rodentia: Spermophilus citellus (Linnaeus, 1766) dt: Europäisches Ziesel;
- Cricetus cricetus (Linnaeus, 1758) dt: Feldhamster;
- Apodemus sylvaticus (Linnaeus, 1758) dt: Waldmaus.
- Eulipotyphla: Erinaceus roumanicus Barrett-Hamilton, 1900 dt: Nördlicher Weißbrustigel.
- Carnivora: Mustela nivalis Linnaeus, 1766 dt: Mauswiesel;
- Martes foina (Erxleben, 1777) dt: Steinmarder.
Vektor- und Erregerfunktion: I. acuminatus kann eine ⇒ Toxikose erregen und fungiert als ⇒ Überträger der Erreger von Tularämie Francisella tularensis (McCoy et Chapin, 1912), der Lyme-Borreliose Borrelia spp., des Q-Fiebers Coxiella burnetii (Derrick, 1939) und des Hazara-Virus, ein für den Menschen nicht pathogenes Mausvirus.
Ixodes apronophorus Schulze, 1924
en: Marsh tick
Synonyme:
I. arvicolae Warburton, 1926;
I. arvicolae danicae Arthur, 1955.
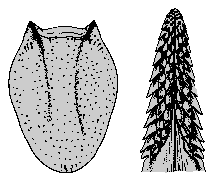 Weibchen: Das längliche Scutum ist etwa ein mm lang und kurz vor der Mitte am breitesten. Besonders an den Rändern ist es stark pigmentiert. Es ist fein und gleichmäßig punktiert und mit einigen wenigen Borstenhaaren (⇒ Setae)n besetzt. Die Scapulae sind kräftig und spitz. Die ⇒ Basis capituli besitzt zwei gut entwickelte ⇒ Cornua. Das ⇒ Hypostom endet spitz und wird nach hinten gleichmäßig breiter. Die Spitzen der jeweils zwölf Seitenzähne sind etwas nach außen gebogen. Auch die Innenzähne sind spitz. Die ⇒ Palpen sitzen auffallend an der Seite der Basis capituli. Ihre Außenseite ist gewölbt, die Innenseite gerade. Das zweite Glied ist länger als das dritte. Die Spirakularplatte ist groß und länglichoval. Die Analfurche ist gut ausgeprägt. Sämtliche ⇒ Coxen besitzen einen gut entwickelten Außendorn, die Coxen des ersten Beinpaares auch einen leicht gebogenen Innendorn. Die ⇒ Pulvilli des ersten Beinpaares sind etwas größer als die der anderen Beine.
Weibchen: Das längliche Scutum ist etwa ein mm lang und kurz vor der Mitte am breitesten. Besonders an den Rändern ist es stark pigmentiert. Es ist fein und gleichmäßig punktiert und mit einigen wenigen Borstenhaaren (⇒ Setae)n besetzt. Die Scapulae sind kräftig und spitz. Die ⇒ Basis capituli besitzt zwei gut entwickelte ⇒ Cornua. Das ⇒ Hypostom endet spitz und wird nach hinten gleichmäßig breiter. Die Spitzen der jeweils zwölf Seitenzähne sind etwas nach außen gebogen. Auch die Innenzähne sind spitz. Die ⇒ Palpen sitzen auffallend an der Seite der Basis capituli. Ihre Außenseite ist gewölbt, die Innenseite gerade. Das zweite Glied ist länger als das dritte. Die Spirakularplatte ist groß und länglichoval. Die Analfurche ist gut ausgeprägt. Sämtliche ⇒ Coxen besitzen einen gut entwickelten Außendorn, die Coxen des ersten Beinpaares auch einen leicht gebogenen Innendorn. Die ⇒ Pulvilli des ersten Beinpaares sind etwas größer als die der anderen Beine.
Männchen: Der Körper ist klein und länglichoval. Die Spirakularplatte ist groß und oval. Die ⇒ Basis capituli besitzt gut entwickelte ⇒ Cornua. Das Hypostom ist nur schwach ausgebildet. Die Zähne sitzen in sieben oder acht Zeilen. Die Seitenzähne sind schwach entwickelt und stumpf. Alle Coxen tragen einen gut entwickelten Außendorn, die des ersten Beinpaares auch einen Innendorn. Die Männchen saugen vermutlich nicht.
Nymphe: Das Scutum ist etwas länger als breit. Die Spirakularplatte ist in Querrichtung etwas gestreckt. Die ⇒ Basis capituli trägt gut entwickelte ⇒ Cornua. Das Hypostom ist im unteren Drittel am breitesten. Die spitzen Zähne sind vorne in drei Reihen, weiter unten in zwei Reihen angeordnet. Alle Coxen besitzen einen Außendorn und, bis auf die des vierten Beinpaares, auch einen Innendorn. An den Coxen des ersten Beinpaares ist der Innendorn größer als der Außendorn.
Larve: Das Scutum ist fast regelmäßig sechseckig, und damit genauso lang wie breit. Die ⇒ Basis capituli trägt stumpfe ⇒ Cornua. Das Hypostom ist im unteren Drittel am breitesten. Es trägt sieben Querreihen von Zähnen. Die Zahnformel lautet 2-2. Die Spitze des Hypostoms ist abgerundet.
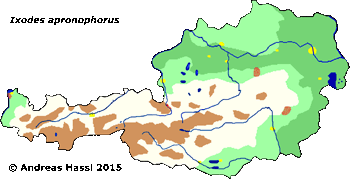
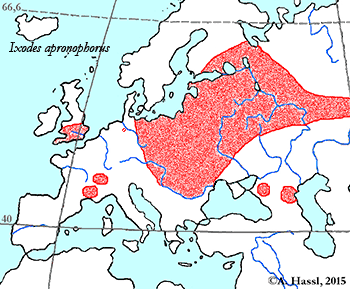 Verbreitung & Bionomie: I. apronophorus wurde in Europa in England, in der Schweiz, Deutschland, Frankreich, Dänemark und Polen aufgefunden. Diese Art wurde auch in Österreich gefunden: In Vorarlberg, ohne genaue Angabe des Fundorts, bei Birkfeld in der Steiermark, in Lunz am See, in Bischofshofen und in einem nicht genau lokalisierbaren Moor in Salzburg. I. apronophorus ist eine ⇒ hygrophile Art und bevorzugt feuchte, morastige ⇒ Habitate wie Moore, Sümpfe, Röhrichtbestände, See- und Flussufer. Wahrscheinlich ist sie in Österreich viel weiter verbreitet als bekannt ist. Die Tiere haben angeblich im April und Mai ein Aktivitätsmaximum. Im Norden ihres Verbreitungsgebiets dauert der Lebenszyklus drei bis vier Jahre.
Verbreitung & Bionomie: I. apronophorus wurde in Europa in England, in der Schweiz, Deutschland, Frankreich, Dänemark und Polen aufgefunden. Diese Art wurde auch in Österreich gefunden: In Vorarlberg, ohne genaue Angabe des Fundorts, bei Birkfeld in der Steiermark, in Lunz am See, in Bischofshofen und in einem nicht genau lokalisierbaren Moor in Salzburg. I. apronophorus ist eine ⇒ hygrophile Art und bevorzugt feuchte, morastige ⇒ Habitate wie Moore, Sümpfe, Röhrichtbestände, See- und Flussufer. Wahrscheinlich ist sie in Österreich viel weiter verbreitet als bekannt ist. Die Tiere haben angeblich im April und Mai ein Aktivitätsmaximum. Im Norden ihres Verbreitungsgebiets dauert der Lebenszyklus drei bis vier Jahre.
Wirte aller Stadien: Scher-, Wühl- und Feldmäuse, vielleicht auch Spitzmäuse. Hauptwirte sind angeblich die Ostschermaus und die Bisamratte.
- Heimische Wirte:
- Rodentia: Arvicola terrestris (Linnaeus, 1758) dt: Ostschermaus;
- Myodes glareolus (Schreber, 1780) dt: Rötelmaus;
- Microtus agrestis (Linnaeus, 1761) dt: Erdmaus;
- Microtus arvalis (Pallas, 1778) dt: Feldmaus;
- Ondatra zibethicus (Linnaeus, 1766) dt: Bisamratte.
- Eulipotyphla: Sorex araneus Linnaeus, 1758 dt: Waldspitzmaus.
Vektorfunktion: I. apronophorus fungiert als ⇒ Überträger von Francisella tularensis (McCoy et Chapin, 1912) auf die Ostschermaus.
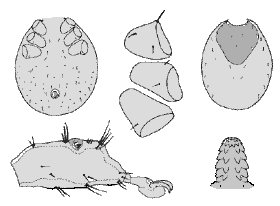
Ixodes (Pholeoixodes) arboricola Schulze et Schlottke, 1929
dt: sehr selten Baumhöhlenzecke genannt, en: Tree-hole tick
Synonyme:
I. arboricola muscicapae Schulze, 1930;
I. strigicola Schulze et Schlottke, 1930;
I. dryadis Schulze et Schlottke, 1930;
I. arboricola domesticus Schulze et Schlottke, 1930;
I. arboricola arboricola Schulze et Schlottke, 1930;
I. passericola Schulze, 1933;
I. arboricola bogatschevi Kirschenblatt, 1936;
Eschatocephalus dryadis Buitendijk, 1945;
I. lagodechiensis Dzhaparidze, 1950;
I. arboricola Sénevet et Ripert, 1967;
Pholeoixodes arboricola Morel et Pérez, 1973.
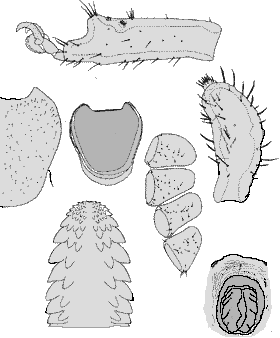 Weibchen: Die Weibchen sind durchschnittlich 1,8 mm breit und 2,8 mm lang. Die Abmessungen des Schildes und die Behaarung desselben variiert sehr stark, sogar innerhalb geschlossener Populationen (Breite etwa 0,82 mm und Länge etwa 0,88 mm). Am Schild wurden 54 bis 60 Borstenhaare (⇒ Setae) gezählt, die oftmals eine schwache Verzweigung zeigen. An der ⇒ Basis capituli fehlen jegliche ⇒ Cornua. Das ⇒ Hypostom ist klein und schmal. Die Innenzähne gehen bis fast zur Mitte, so dass sich dort nur ein sehr schmaler zahnfreier Bereich befindet. Die Tarsen des ersten Beinpaares verjüngt sich jäh. Der Palpus ist 0,37 mm lang und 0,16 mm breit; die randständigen Borstenhaare (Setae) sind wie bei den Nymphen meist stark gefiedert. Der Palpentarsus trägt spitze und abgerundete Dornen. Die ⇒ Chelizeren tragen sechs oder acht Haken. Das ⇒ Hypostom ist 0,24 mm lang und an der Basis 0,15 mm breit; es ist in der randständigen Reihe aus sieben großen und vier oder drei weiteren, etwas unscheinbareren Zähnen aufgebaut. Die Borstenhaare (Setae) sind alle glatt und dornenförmig. Die Analöffnung ist von einem Chitinring umgeben und trägt vier Paar glatte Genitaldornen, die 0,03 bis 0,036 mm (selten über 0,05 mm) lang sind. Die Analplatte ist 0,176 mm lang und 0,14 mm breit. Das elliptisch geformte Stigma misst 0,17 mm in der Breite und 0,19 bis 0,2 mm in der Länge.
Weibchen: Die Weibchen sind durchschnittlich 1,8 mm breit und 2,8 mm lang. Die Abmessungen des Schildes und die Behaarung desselben variiert sehr stark, sogar innerhalb geschlossener Populationen (Breite etwa 0,82 mm und Länge etwa 0,88 mm). Am Schild wurden 54 bis 60 Borstenhaare (⇒ Setae) gezählt, die oftmals eine schwache Verzweigung zeigen. An der ⇒ Basis capituli fehlen jegliche ⇒ Cornua. Das ⇒ Hypostom ist klein und schmal. Die Innenzähne gehen bis fast zur Mitte, so dass sich dort nur ein sehr schmaler zahnfreier Bereich befindet. Die Tarsen des ersten Beinpaares verjüngt sich jäh. Der Palpus ist 0,37 mm lang und 0,16 mm breit; die randständigen Borstenhaare (Setae) sind wie bei den Nymphen meist stark gefiedert. Der Palpentarsus trägt spitze und abgerundete Dornen. Die ⇒ Chelizeren tragen sechs oder acht Haken. Das ⇒ Hypostom ist 0,24 mm lang und an der Basis 0,15 mm breit; es ist in der randständigen Reihe aus sieben großen und vier oder drei weiteren, etwas unscheinbareren Zähnen aufgebaut. Die Borstenhaare (Setae) sind alle glatt und dornenförmig. Die Analöffnung ist von einem Chitinring umgeben und trägt vier Paar glatte Genitaldornen, die 0,03 bis 0,036 mm (selten über 0,05 mm) lang sind. Die Analplatte ist 0,176 mm lang und 0,14 mm breit. Das elliptisch geformte Stigma misst 0,17 mm in der Breite und 0,19 bis 0,2 mm in der Länge.
Männchen: Die ⇒ Basis capituli ist glatt und es gibt keine ⇒ Cornua. Die Spitze des rudimentären Hypostoms ist geteilt. Die Innenzähne bilden gezackte Kämme. Auf dem Scutum befinden sich punktfreie Gebiete. Die Männchen saugen wahrscheinlich nicht und leben auch nicht am Wirt.
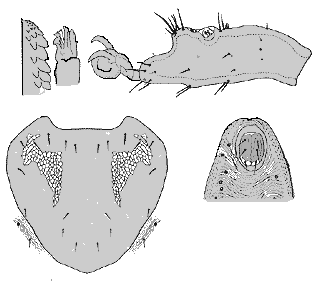 Nymphe: Die Gesamtlänge variiert auffallend stark. Inklusive Hypostom beträgt die Länge zwischen 1,36 und 1,5 mm und die Breite 0,84 bis 0,9 mm. Der herzförmige Schild ist 0,44 mm (0,42 bis 0,46 mm) breit und 0,44 mm (0,48 bis 0,5 mm) lang und hat eine gitterförmige Oberflächenstruktur. Die Schildhaare sind meist unregelmäßig angeordnet, variieren zahlenmäßig zwischen 18 und 20, und sie sind glatt, seitlich manchmal einfach gefiedert. Der Palpus misst in der Länge 0,176 mm und in der Breite 0,08 mm. Die am Rande angeordneten Borstenhaare (Setae) sind meist stark gefiedert, während die Borstenhaare (Setae) an der Spitze des Palpentarsus und teilweise zentral an der Palpentibia glatt und dornenförmig sind. Die Oberfläche der Borstenhaare (Setae) ist rau und eingekerbt (Artefakt?). Die ⇒ Chelizeren zeigen fünf oder sieben zackenförmige Haken. Das Hypostom ist in der randständigen Reihe von sechs großen und sechs kleinen, etwas nach rückwärts gerichteten Zähnen bedeckt. Die ⇒ Coxen aller Beine sind etwa 0,15 mm breit, die Coxa des ersten Beinpaares 0,16 mm, und die des zweiten bis vierten Beinpaares etwa 0,23 mm lang. Wie die Größenmaße variiert auch die Anzahl der Coxensetae, die meist glatt und nur selten wie die Frontalborste auf Coxa I gefiedert sind. Die Borstenhaare (Setae) sind alle ungefiedert glatt und dornenförmig. Die zweiteilige Analplatte ist von einem Ring umgeben und misst mit diesem in der Länge 0,106 mm und in der Breite 0,06 mm. Die drei paarigen Genitaldornen sind glatt und zwischen 0,028 mm und 0,040 mm lang. Die Tracheenöffnungen sind elliptisch gebaut, 0,102 mm lang und 0,072 mm breit. Die ventralen Körperhaare haben eine Länge von 0,024 bis 0,028 mm bzw. 0,034 bis 0,036 mm.
Nymphe: Die Gesamtlänge variiert auffallend stark. Inklusive Hypostom beträgt die Länge zwischen 1,36 und 1,5 mm und die Breite 0,84 bis 0,9 mm. Der herzförmige Schild ist 0,44 mm (0,42 bis 0,46 mm) breit und 0,44 mm (0,48 bis 0,5 mm) lang und hat eine gitterförmige Oberflächenstruktur. Die Schildhaare sind meist unregelmäßig angeordnet, variieren zahlenmäßig zwischen 18 und 20, und sie sind glatt, seitlich manchmal einfach gefiedert. Der Palpus misst in der Länge 0,176 mm und in der Breite 0,08 mm. Die am Rande angeordneten Borstenhaare (Setae) sind meist stark gefiedert, während die Borstenhaare (Setae) an der Spitze des Palpentarsus und teilweise zentral an der Palpentibia glatt und dornenförmig sind. Die Oberfläche der Borstenhaare (Setae) ist rau und eingekerbt (Artefakt?). Die ⇒ Chelizeren zeigen fünf oder sieben zackenförmige Haken. Das Hypostom ist in der randständigen Reihe von sechs großen und sechs kleinen, etwas nach rückwärts gerichteten Zähnen bedeckt. Die ⇒ Coxen aller Beine sind etwa 0,15 mm breit, die Coxa des ersten Beinpaares 0,16 mm, und die des zweiten bis vierten Beinpaares etwa 0,23 mm lang. Wie die Größenmaße variiert auch die Anzahl der Coxensetae, die meist glatt und nur selten wie die Frontalborste auf Coxa I gefiedert sind. Die Borstenhaare (Setae) sind alle ungefiedert glatt und dornenförmig. Die zweiteilige Analplatte ist von einem Ring umgeben und misst mit diesem in der Länge 0,106 mm und in der Breite 0,06 mm. Die drei paarigen Genitaldornen sind glatt und zwischen 0,028 mm und 0,040 mm lang. Die Tracheenöffnungen sind elliptisch gebaut, 0,102 mm lang und 0,072 mm breit. Die ventralen Körperhaare haben eine Länge von 0,024 bis 0,028 mm bzw. 0,034 bis 0,036 mm.
 Larve: Das Schild ist herzförmig mit ausgeprägten seitlichen Ausbuchtungen. Die größte Breite des Schildes beträgt 0,28 mm und die größte Länge 0,24 mm. Der Abstand der beiden vorderen Schildkanten ist 0,12 bis 0,13 mm. Die Länge der zehn Schildsetae, die symmetrisch angeordnet sind, ist 0,02 mm. Die ⇒ Palpen sind 0,11 mm lang und 0,05 mm breit. Die Borstenhaare (Setae) sind etwas gefiedert bzw. am vierten Segment des Palpus (Palpaltarsus) glatt, spitz oder abgerundet. Die ⇒ Chelizeren zeigen eine charakteristische fünf- bis sechs-fache Zähnung, und das Hypostom hat bei einer Länge von 0,08 mm und einer Breite von 0,056 mm außen fünf große und vier kleine Zähne. Die mittlere Länge der ⇒ Coxen I bis III beträgt in der Reihenfolge 0,10 mm, 0,12 mm, 0,12 mm und die mittlere Breite 0,1 mm. Der Tarsus I ist 0,17 mm lang und 0,085 mm breit. Der Praetarsus misst 0,08 mm. Die Tarsalsetae sind kaum oder überhaupt nicht gefiedert. Die Breite des Tarsus II ist 0,06 mm und die Länge 0,086 mm; der Praetarsus ist 0,074 mm lang. Die Länge des Tarsus III ist 0,102 mm und die des Praetarsus 0,07 mm. Der Tarsus III ist 0,052 mm breit. Die Analplatte ist rundlich, zweigeteilt und von einem Chitinring umgeben; mit letzterem ist sie 0,04 mm lang und 0,038 mm breit. Die zwei Genitaldornen sind glatt und 0,022 mm lang. Die anderen Körperhaare messen je nach Länge 0,02 mm bis 0,024 mm.
Larve: Das Schild ist herzförmig mit ausgeprägten seitlichen Ausbuchtungen. Die größte Breite des Schildes beträgt 0,28 mm und die größte Länge 0,24 mm. Der Abstand der beiden vorderen Schildkanten ist 0,12 bis 0,13 mm. Die Länge der zehn Schildsetae, die symmetrisch angeordnet sind, ist 0,02 mm. Die ⇒ Palpen sind 0,11 mm lang und 0,05 mm breit. Die Borstenhaare (Setae) sind etwas gefiedert bzw. am vierten Segment des Palpus (Palpaltarsus) glatt, spitz oder abgerundet. Die ⇒ Chelizeren zeigen eine charakteristische fünf- bis sechs-fache Zähnung, und das Hypostom hat bei einer Länge von 0,08 mm und einer Breite von 0,056 mm außen fünf große und vier kleine Zähne. Die mittlere Länge der ⇒ Coxen I bis III beträgt in der Reihenfolge 0,10 mm, 0,12 mm, 0,12 mm und die mittlere Breite 0,1 mm. Der Tarsus I ist 0,17 mm lang und 0,085 mm breit. Der Praetarsus misst 0,08 mm. Die Tarsalsetae sind kaum oder überhaupt nicht gefiedert. Die Breite des Tarsus II ist 0,06 mm und die Länge 0,086 mm; der Praetarsus ist 0,074 mm lang. Die Länge des Tarsus III ist 0,102 mm und die des Praetarsus 0,07 mm. Der Tarsus III ist 0,052 mm breit. Die Analplatte ist rundlich, zweigeteilt und von einem Chitinring umgeben; mit letzterem ist sie 0,04 mm lang und 0,038 mm breit. Die zwei Genitaldornen sind glatt und 0,022 mm lang. Die anderen Körperhaare messen je nach Länge 0,02 mm bis 0,024 mm.
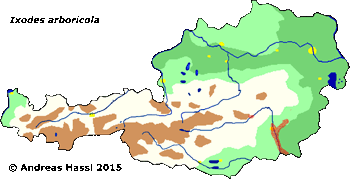
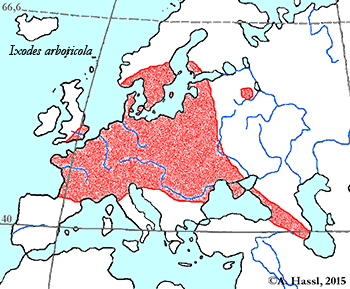 Verbreitung & Bionomie: Es handelt sich um eine streng ⇒ ornithophile und ⇒ nidikole Zecke. Die Merkmale einzelner Individuen können stark voneinander abweichen. Es wurden zwar vier Unterarten beschrieben, die Berechtigung dafür wird aber allgemein bezweifelt. Diese Zecke ist in zahlreichen europäischen Staaten, ua in Südengland, Frankreich, Belgien, Holland, Norwegen, Polen, Deutschland, Holland, der Schweiz, der Ukraine, Ungarn, Rumänien, Dänemark, Schweden, Österreich cit. Sixl [1971b], Mähren und der ehem. SSR in Baumhöhlen von Vögeln gefunden worden. Außerhalb von Europa gibt es Funde in Israel, Georgien, Azerbaijan, Afghanistan, in der Mongolei, China, Russland, und Ägypten. Im Süden und Südosten Österreichs konnten in 4,5% der Baumhöhlen alle Stadien dieser Zecken-Art nachgewiesen werden. Alle Stadien können sowohl in den Baumhöhlen als auch auf den Wirten das ganze Jahr (Brutsaison?) hindurch gefunden werden. Männchen treten jedoch ausgesprochen selten auf. Weibchen, Nymphen und Larven fanden sich im Verhältnis 1:9:41 im Nistmaterial der Bruthöhlen, ein Männchen wurde im Bodenmaterial gefunden. Der Höhepunkt der Parasitierung liegt im Mai, Weibchen treten bevorzugt im Frühjahr auf, danach die Larven und Nymphen. cit.
Sixl [1971c]. In Deutschland allerdings wurde in einer Untersuchung die höchste ⇒ Abundanz dieser Zecke auf Meisen im Winter gefunden, woraus auch der Tod des Wirtes resultieren kann. cit. Hudde et Walter [1988]. Bis zu 74% der Küken von Wanderfalken können am Zeckenbefall in jenen Nestern in Felsgrotten sterben, in denen bis zu 320 Zecken an einem Küken gefunden wurden. cit. Schilling et al. [1981].
Verbreitung & Bionomie: Es handelt sich um eine streng ⇒ ornithophile und ⇒ nidikole Zecke. Die Merkmale einzelner Individuen können stark voneinander abweichen. Es wurden zwar vier Unterarten beschrieben, die Berechtigung dafür wird aber allgemein bezweifelt. Diese Zecke ist in zahlreichen europäischen Staaten, ua in Südengland, Frankreich, Belgien, Holland, Norwegen, Polen, Deutschland, Holland, der Schweiz, der Ukraine, Ungarn, Rumänien, Dänemark, Schweden, Österreich cit. Sixl [1971b], Mähren und der ehem. SSR in Baumhöhlen von Vögeln gefunden worden. Außerhalb von Europa gibt es Funde in Israel, Georgien, Azerbaijan, Afghanistan, in der Mongolei, China, Russland, und Ägypten. Im Süden und Südosten Österreichs konnten in 4,5% der Baumhöhlen alle Stadien dieser Zecken-Art nachgewiesen werden. Alle Stadien können sowohl in den Baumhöhlen als auch auf den Wirten das ganze Jahr (Brutsaison?) hindurch gefunden werden. Männchen treten jedoch ausgesprochen selten auf. Weibchen, Nymphen und Larven fanden sich im Verhältnis 1:9:41 im Nistmaterial der Bruthöhlen, ein Männchen wurde im Bodenmaterial gefunden. Der Höhepunkt der Parasitierung liegt im Mai, Weibchen treten bevorzugt im Frühjahr auf, danach die Larven und Nymphen. cit.
Sixl [1971c]. In Deutschland allerdings wurde in einer Untersuchung die höchste ⇒ Abundanz dieser Zecke auf Meisen im Winter gefunden, woraus auch der Tod des Wirtes resultieren kann. cit. Hudde et Walter [1988]. Bis zu 74% der Küken von Wanderfalken können am Zeckenbefall in jenen Nestern in Felsgrotten sterben, in denen bis zu 320 Zecken an einem Küken gefunden wurden. cit. Schilling et al. [1981].
Wirte aller Stadien: Viele Arten von heimischen Vögeln. Häufigste Zecke der Hausspatzen. In Österreich nachgewiesene Wirtsvogelarten: Wiedehopf, Kohlmeise und Kleiber.
- Heimische Wirte:
- Piciformes: Picus canus Gmelin, 1788 dt: Grauspecht;
- Dendrocopos major (Linnaeus, 1758).
- Passeriformes: Parus major Linnaeus, 1758 dt: Kohlmeise;
- Periparus ater Linnaeus, 1758 dt: Tannenmeise;
- Poecile montanus (Conrad von Baldenstein, 1827) dt: Weidenmeise;
- Cyanistes caeruleus Linnaeus, 1758 dt: Blaumeise;
- Certhia familiaris (Linnaeus, 1758) dt: Waldbaumläufer;
- Sitta europaea (Linnaeus, 1758) dt: Kleiber;
- Ficedula albicollis (Temminck, 1815) dt: Halsbandschnäpper;
- Sturnus vulgaris Linnaeus, 1758 dt: Star;
- Passer montanus (Linnaeus, 1758) dt: Feldsperling cit. Siuda et al., 2006;
- Passer domesticus Linnaeus, 1758 dt: Haussperling;
- Corvus monedula Linnaeus, 1758 dt: Dohle.
- Strigiformes: Tyto alba (Scopoli, 1769) dt: Schleiereule;
- Strix aluco Linnaeus, 1758 dt: Waldkauz.
- Falconiformes: Falco peregrinus Tunstall, 1771 dt: Wanderfalke.
- Bucerotiformes: Upupa epops Linnaeus, 1758 dt: Wiedehopf.
Vektorfunktion: I. arboricola fungiert als Vektor für das Virus der Frühsommer-Meningoenzephalitis (FSME) und als ⇒ Überträger von Borrelia burgdorferi s.l. Johnson et al., 1984 emend. Baranton et al., 1992.
Ixodes (Eschatocephalus) ariadnae Hornok et al., 2014
Synonyme: Synonyme Benennungen sind nicht bekannt.
Weibchen: Die Körperlänge beträgt sechs mm. Die Beine sind lang, der erste Tarsus 1,5 mm lang. Das Haller`sche Organ ist offen, lang, zusammenlaufend, mit elf Borsten in drei Gruppen. Auf der ⇒ Basis capituli postero-lateral ein stumpfer, hervorspringender Rand, der hintere Rand mit einem dorsalen Grat mit der maximalen Breite von 0,5 mm. Die ⇒ Palpen sind kurz, 0,44 mm breit. Die Verbindung von Segmenten II zu III ist deutlich ausgeprägt. Das ⇒ Hypostom ist von mittlerer Länge, 0,35 mm lang. Es hat 10 Querreihen von breiten Zähnen, ventral in vier Spalten angeordnet. Die Zahnformel lautet 2-2 in 10 Reihen. Das Scutum ist gewölbt, breit sechseckig, mit einem Länge:Breite-Index von 1,2. Das ⇒ Idiosoma ist sowohl dorsal als auch ventral schütter beborstet. Die ⇒ Coxen sind postero-external ⇒ konvex geformt, mit abgerundeter Oberfläche. Die ⇒ Genitalöffnung liegt zwischen den dritten Coxen. Die Analfalte verläuft nach hinten divergent. Die Spirakularöffnungen sind oval mit unregelmäßigem Umriss.
Männchen: Dieses Stadium wurde bislang nicht beschrieben, weil es noch nicht gefunden wurde oder nicht existiert.
 Nymphe: Die Körperlänge beträgt drei mm. Die Beine sind mäßig lang, der erste Tarsus ist 0,75 mm lang. Die maximale Breite der ⇒ Basis capituli beträgt 0,35 mm. Die ⇒ Palpen sind kurz, 0,2 mm lang. Das zweite und das dritte Segment ist jeweils 0,125 bzw. 0,075 mm lang. Es gibt eine deutlich erkennbare Verbindung von Segment zwei zu drei. Das Hypostom ist von mittlerer Länge, 0,13 mm lang. Das Scutum ist gewölbt, breit hexagonal, die Länge beträgt 0,72 mm, die Breite 0,6 mm. Der Länge:Breite-Index ist 1,2. Das ⇒ Idiosoma ist schütter beborstet, sowohl dorsal als auch ventral. Die Spirakularöffnungen sind oval, mit einem unregelmäßigen Umriss.
Nymphe: Die Körperlänge beträgt drei mm. Die Beine sind mäßig lang, der erste Tarsus ist 0,75 mm lang. Die maximale Breite der ⇒ Basis capituli beträgt 0,35 mm. Die ⇒ Palpen sind kurz, 0,2 mm lang. Das zweite und das dritte Segment ist jeweils 0,125 bzw. 0,075 mm lang. Es gibt eine deutlich erkennbare Verbindung von Segment zwei zu drei. Das Hypostom ist von mittlerer Länge, 0,13 mm lang. Das Scutum ist gewölbt, breit hexagonal, die Länge beträgt 0,72 mm, die Breite 0,6 mm. Der Länge:Breite-Index ist 1,2. Das ⇒ Idiosoma ist schütter beborstet, sowohl dorsal als auch ventral. Die Spirakularöffnungen sind oval, mit einem unregelmäßigen Umriss.
Larve: Dieses Stadium wurde bislang noch nicht beschrieben. Vermutlich wurde es nicht als Larve dieser Art erkannt oder wegen seiner versteckten Lebensweise noch gar nicht aufgefunden.
Verbreitung & Bionomie: Da die Art erst 2014 beschrieben wurde, ist über sie sehr wenig bekannt. cit. Hornok et al. [2014]. Versucht man aus den bekannten Fakten etwas zur Bionomie der Art zu erschließen, dann kommt man zum Schluss, dass es sich um eine kavernikole Art handeln muss, möglicherweise sogar um einen Teil der Höhlenfauna. Jedenfalls verlassen zumindest die Larven ihre Wirte, um als Spinnen-förmige Nymphen Wirtstiere neu zu befallen. Dabei laufen sie ähnlich den Weberknechten über die Oberflächen der Höhlen. Alle bekannt gewordenen Wirtstiere sind in Erd- und Felshöhlen rastende oder überwinternde, sozial lebende und gemischte Kleinkolonien bildende Fledermäuse. Versucht man die ⇒ ökologischen Anforderungen und die Verbreitungsareale dieser Fledermäuse zu erwägen, dürfte das Verbreitungsareal von I. ariadnae in Festlandeuropa von Nordspanien über Frankreich, Deutschland, Österreich, Norditalien, Südpolen, Ungarn bis nach Rumänien und Griechenland reichen. Ich vermute, dass es sich um eine hochspezialisierte, ⇒ kavernikole Zecken-Art mit kontinentaleuropäischer Verbreitung handelt.
Wirte: Diese Zecken-Art ist wahrscheinlich wirtsspezifisch auf Unterordnungs-Niveau: Sie saugt nur an Fledermäusen, dh an Tieren der Unterordnung Microchiroptera. Bislang sind nur drei Wirtstierarten parasitiert gefunden worden.
- Heimische Wirte aller Stadien:
- Chiroptera: Myotis alcathoe von Helversen et Heller, 2001 dt: Nymphenfledermaus; diese Art wurde in fast allen Nachbarstaaten Österreichs nachgewiesen, nicht aber in Österreich;
- Myotis blythii (Tomes, 1857) dt: Kleines Mausohr; nur vereinzelt in Österreich gefunden;
- Plecotus auritus Linnaeus, 1758 dt: Braunes Langohr.
Erreger- und Vektorfunktion: Nicht bekannt.
Ixodes canisuga Johnston, 1849
dt: Fuchszecke, en: dog tick or fox tick
Abb. VIII.5.24: Ixodes canisuga ♀.
© University of Bristol.
Kaum eine andere heimische Zecken-Art ist unter so verschiedenen Namen immer wieder „erstbeschrieben” worden wie die Fuchszecke. Daher ist bis heute die Beschreibung unpräzis geblieben und ältere Fundmeldungen sind mit großer Vorsicht zu verwerten. Ich halte diese Zecke für eine gute ⇒ biologische Art und für einen ⇒ nidikolen Spezialisten in Fuchsbauten, der auch Nebenwirte nutzen kann. Für die immer wieder behauptete nahe Verwandtschaft mit I. hexagonus habe ich keine Hinweise gefunden, wohl aber für zahllose Verwechslungen und Fehlzuschreibungen in der Bionomie. An Hunden in England ist die Fuchszecke mit 5,6% Befallshäufigkeit die dritthäufigst gefundene Schildzecke, nach dem Gemeinen Holzbock (72%) und der Igelzecke (21,7%); cit. Smith et al. [2011]).
Synonyme:
I. inermis Neumann, 1901;
I. hexagonus inchoatus Neumann, 1901;
I. vulpis Schulze et Schlottke, 1930;
I. melicola Schulze et Schlottke, 1930;
I. autumnalis vulpis Schulze et Schlottke, 1930;
I. crenulatus Schulze et Schlottke, 1930;
I. autumnalis Schulze et Schlottke, 1930;
I. sciuricola Schulze, 1933;
I. vulpinus Schulze, 1937;
I. vulpicola Schulze, 1937;
I. latirostris Schulze, 1937;
I. barbarossae Schulze, 1937;
I. mammulatus Feider et Mironescu, 1970;
Pholeoixodes canisuga Morel et Pérez, 1973.
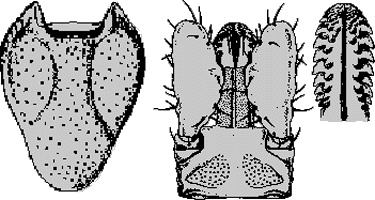 Weibchen: Vollgesogene Weichen sind bis 8 mm lang, nüchterne 2,8 bis 3,2 mm. Das Scutum, das ⇒ Capitulum und die Beine sind kastanienbraun, der Rest des Körpers ist gelb. Das Scutum ist länglich herzförmig, etwa 1,2 mm lang. Die Zervikalfurchen darauf sind S-förmig gekrümmt. Dort, wo sie den hinteren Rand treffen, ist dieser etwas eingebuchtet. Die Scapulae sind kräftig und spitz. Das Scutum ist fein und spärlich punktiert. Auf der ⇒ Basis capituli befinden sich keine ⇒ Cornua, ihre hinteren seitlichen Enden sind allerdings zugespitzt. Die ⇒ Areae porosae sind groß und birnenförmig und, außer auf der dem Körper zugewandten Seite, von einer Chitinleiste umgeben. Die ⇒ Palpen sind lang und massiv. Ihre Außenseiten sind gerade und faltig. Die Innenseiten sind gewölbt. Ein viertes Palpenglied ist als kleine Cuticula-Mütze dem dritten aufgesetzt. Das ⇒ Hypostom ist lang und dick (Länge zu Breite ist 2:1), am breitesten auf Höhe des 4. Seitenzahns von oben. Es hat sieben Seitenzähne. Neben jedem sitzt ein stumpfer Innenzahn. Die Zähne auf der Spitze sind winzig. Die Mitte des Hypostoms ist auf großer Fläche zahnfrei. Die Spirakularplatte ist oval. Die Spirakularöffnung ist groß. Die Beincoxen tragen keine Dornen, höchsten das hintere Ende des ersten Beinpaares ist zugespitzt. Der Höcker am Ende der Tarsi des ersten Beinpaares ist höher als das Haller`sche Organ.
Weibchen: Vollgesogene Weichen sind bis 8 mm lang, nüchterne 2,8 bis 3,2 mm. Das Scutum, das ⇒ Capitulum und die Beine sind kastanienbraun, der Rest des Körpers ist gelb. Das Scutum ist länglich herzförmig, etwa 1,2 mm lang. Die Zervikalfurchen darauf sind S-förmig gekrümmt. Dort, wo sie den hinteren Rand treffen, ist dieser etwas eingebuchtet. Die Scapulae sind kräftig und spitz. Das Scutum ist fein und spärlich punktiert. Auf der ⇒ Basis capituli befinden sich keine ⇒ Cornua, ihre hinteren seitlichen Enden sind allerdings zugespitzt. Die ⇒ Areae porosae sind groß und birnenförmig und, außer auf der dem Körper zugewandten Seite, von einer Chitinleiste umgeben. Die ⇒ Palpen sind lang und massiv. Ihre Außenseiten sind gerade und faltig. Die Innenseiten sind gewölbt. Ein viertes Palpenglied ist als kleine Cuticula-Mütze dem dritten aufgesetzt. Das ⇒ Hypostom ist lang und dick (Länge zu Breite ist 2:1), am breitesten auf Höhe des 4. Seitenzahns von oben. Es hat sieben Seitenzähne. Neben jedem sitzt ein stumpfer Innenzahn. Die Zähne auf der Spitze sind winzig. Die Mitte des Hypostoms ist auf großer Fläche zahnfrei. Die Spirakularplatte ist oval. Die Spirakularöffnung ist groß. Die Beincoxen tragen keine Dornen, höchsten das hintere Ende des ersten Beinpaares ist zugespitzt. Der Höcker am Ende der Tarsi des ersten Beinpaares ist höher als das Haller`sche Organ.
 Männchen: Das Männchen ist kastanienbraun und nüchtern 2,0 bis 2,2 mm lang. Das Scutum ist oval. Die Furchen darauf sind undeutlich und zu länglichen Vertiefungen umgebildet. Das ⇒ Capitulum ist klein. Die seitlichen Ecken sind rechtwinklig, die Vorderkante sanft gewölbt. Die ⇒ Palpen sind kurz, stumpf und wirken massiv. Ihr Trochanter ist nicht ganz mit der ⇒ Basis capituli verschmolzen. Die Seiten des Hypostoms verlaufen bis auf an der Spitze parallel. An der Spitze befindet sich eine Einkerbung. Bis auf am unteren Drittel stehen sieben Reihen von zackigen Kämmen auf dem Hypostom. Die Spirakularplatte ist so wie die des Weibchens, nur kleiner. Die Beincoxen tragen keine Dornen, nur an der des ersten Beinpaares befindet sich wie beim Weibchen eine Innenspitze. Statt der Außendornen gibt es stumpfe Erhebungen. Die Medianplatte hat eine kurze vordere und eine längere hintere Kante. Es gibt sowohl eine Adanal- als auch eine Analplatte (= epimeral plate), die fast so groß ist wie die Medianplatte.
Männchen: Das Männchen ist kastanienbraun und nüchtern 2,0 bis 2,2 mm lang. Das Scutum ist oval. Die Furchen darauf sind undeutlich und zu länglichen Vertiefungen umgebildet. Das ⇒ Capitulum ist klein. Die seitlichen Ecken sind rechtwinklig, die Vorderkante sanft gewölbt. Die ⇒ Palpen sind kurz, stumpf und wirken massiv. Ihr Trochanter ist nicht ganz mit der ⇒ Basis capituli verschmolzen. Die Seiten des Hypostoms verlaufen bis auf an der Spitze parallel. An der Spitze befindet sich eine Einkerbung. Bis auf am unteren Drittel stehen sieben Reihen von zackigen Kämmen auf dem Hypostom. Die Spirakularplatte ist so wie die des Weibchens, nur kleiner. Die Beincoxen tragen keine Dornen, nur an der des ersten Beinpaares befindet sich wie beim Weibchen eine Innenspitze. Statt der Außendornen gibt es stumpfe Erhebungen. Die Medianplatte hat eine kurze vordere und eine längere hintere Kante. Es gibt sowohl eine Adanal- als auch eine Analplatte (= epimeral plate), die fast so groß ist wie die Medianplatte.
Nymphe: Die Nymphe ist oval, etwa 2 mm lang und 1,3 mm breit. Die Vorderkante und die Seitenkanten des ⇒ Capitulums bilden einen Rundbogen. Die Außenseiten der ⇒ Palpen sind wellig, die Innenseite gewölbt. Das Hypostom besitzt sieben Seitenzähne, neben jedem ein stumpfer Innenzahn. Es ist in der Höhe des dritten Seitenzahns von oben am breitesten. Die Spirakularplatte ist klein und rund. Die Spirakularöffnung liegt in der Mitte.
Larve: Es konnten keine Angaben zur Larve gefunden werden. Es wird behauptet, dass die Weibchen die Eier nicht in denFuchsbau sondern außerhalb von diesem in den Erdboden legen. In diesem Fall müssen die Larven den Erstwirt erst aufsuchen, wozu sie an der Bauöffnung am Boden herumkrabbeln. Dieses Verhalten könnte dazu führen, dass die Larven bevorzugt Jungfüchse beim Erkunden der Umgebung des Baues befällen, eine epidemiologisch sinnvolle Vorgangsweise. Die Larven werden so wahrscheinlich nach kurzer Hungerzeit bereits zur ersten Blutmahlzeit kommen und sich danach rasch zur Nymphe häuten. Deshalb könnten sie so selten im Bau und/oder am Wirt auffindbar sein, dass man sie bisher übersehen hat.
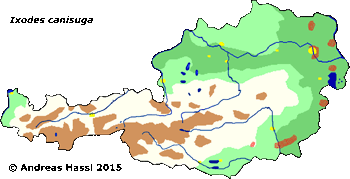
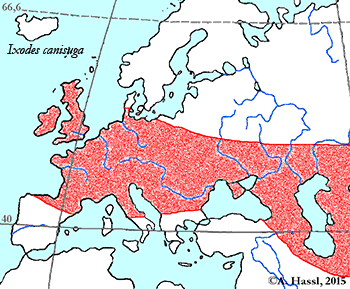 Verbreitung & Bionomie: Durch die Unsicherheiten bei der Artabgrenzung bestehen Unsicherheiten bei der Richtigkeit von früheren Angaben zur Biologie der Zecke und ihrer Wirte. I. canisuga ist wahrscheinlich weit verbreitet. Die Art kommt in Europa zumindest in England, Deutschland, Österreich und Ungarn vor. Die Karte rechts zeigt die Verbreitung in Europa, wenn man die Fuchszecke und I. (Pholeoixodes) crenulatus in eine Art stellt. In Frankreich sind die Hälfte aller Füchse damit infestiert. In Großbritannien sind 11% der Zecken an Hunden dieser Art zugehörig. Es handelt sich um eine ⇒ nidikole Art, die in den Bauten ihrer Wirte zu finden sind. Die vollgesogenen Weibchen kriechen in Erdspalten Richtung Erdboden, da sie vermutlich ihre Eier nicht im Bau ablegen. cit. Obsomer et al. [2013].
Verbreitung & Bionomie: Durch die Unsicherheiten bei der Artabgrenzung bestehen Unsicherheiten bei der Richtigkeit von früheren Angaben zur Biologie der Zecke und ihrer Wirte. I. canisuga ist wahrscheinlich weit verbreitet. Die Art kommt in Europa zumindest in England, Deutschland, Österreich und Ungarn vor. Die Karte rechts zeigt die Verbreitung in Europa, wenn man die Fuchszecke und I. (Pholeoixodes) crenulatus in eine Art stellt. In Frankreich sind die Hälfte aller Füchse damit infestiert. In Großbritannien sind 11% der Zecken an Hunden dieser Art zugehörig. Es handelt sich um eine ⇒ nidikole Art, die in den Bauten ihrer Wirte zu finden sind. Die vollgesogenen Weibchen kriechen in Erdspalten Richtung Erdboden, da sie vermutlich ihre Eier nicht im Bau ablegen. cit. Obsomer et al. [2013].
Die Fuchszecke dürfte ein Spezialist und ein Bewohner von Erdbauten von heimischen Raubsäugern, hauptsächlich von Füchsen, sein. Der Fuchs ist zweifelsohne auch der Hauptwirt, daneben nützt die Zecke allerdings auch den Dachs und Hunde als Wirte. Möglicherweise fungiert aber der Dachs nur im Falle des Bewohnens eines Fuchsbaus als Nebenwirt. Fraglich ist, ob diese Zecken-Art auch im Winter aktiv ist. Dann wäre sie sicherlich überall zu finden, wo Füchse in ihren Bauten ganzjährig überdauern. Zumindest in Österreich wäre sie dann ⇒ ubiquitär und weit verbreitet. Es handelt sich höchstwahrscheinlich um einen Zivilisationsgewinner, da die Füchse derzeit in die Städte einwandern und man von einem Anstieg der Fuchspopulationen ausgeht. Es ist eine der wenigen Zecken, die den Menschen gerne als Wirt akzeptiert und - wenn sie Gelegenheit findet - auch prompt befällt.
Wirte aller Stadien: Baubewohnende Raubsäuger und gelegentlich andere Säugetiere.
- Heimische Wirte:
- Primates: Homo sapiens Linnaeus, 1758 dt: Mensch.
- Carnivora: Canis lupus familiaris (Linnaeus, 1758) dt: Haushund;
- Vulpes vulpes (Linnaeus, 1758) dt: Rotfuchs;
- Meles meles (Linnaeus, 1758) dt: Europäischer Dachs;
- Martes foina (Erxleben, 1777) dt: Steinmarder;
- Mustela erminea Linnaeus, 1758 dt: Hermelin.
Erreger- und Vektorfunktion: I. canisuga kann bei Hunden im Falle einer massiven Infestation Hautentzündung, Ausschlag, Haarausfall und Blutarmut hervorrufen. Zecken dieser Art beherbergen und überträgen vielleicht auch das Virus der Frühsommer-Meningoenzephalitis (FSME), Borrelia burgdorferi s.l. Johnson et al., 1984 emend. Baranton et al., 1992 und in Russland den Pesterreger, Yersinia pestis (Lehmann et Neumann), 1896. Allerdings fehlen Angaben zur Reservoirfunktion dieser Art und zur Bedeutung der Lebensstadien im Zyklus der genannten Erreger.
Ixodes (Trichotoixodes) frontalis (Panzer, 1798)
en: Passerine tick
Abb. VIII.5.29: Ixodes frontalis ♀. © unbekannt.
Synonyme:
Acarus frontalis Panzer, 1798;
I. pari Leach, 1815;
I. pallipes Koch, 1844;
I. brunneus Koch, 1844; als Larve: I. sturni Pagenstecher, 1861;
I. avisugus Berlese, 1889;
I. kellogi Nuttall et Warburton, 1907;
Euixodes frontalis Bonnet, 1908;
I. frontalis frontalis Neumann, 1911;
I. apronatus Kirschenblatt, 1934;
I. tordi Armstrong, 1953;
I. sigalasi Lamontellerie, 1954;
I. segalasi Euzéby, 1957;
Scaphixodes frontalis Camicas et Morel, 1977.
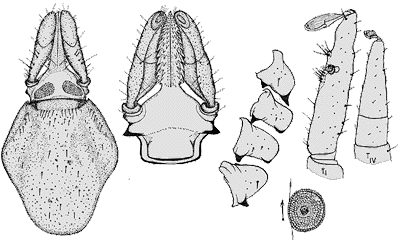 Weibchen: Der Körper ist oval und kurz hinter der Mitte am breitesten. Es ist eine kleine Zecken-Art, die Körperlänge beträgt nüchtern 3,2 mm, die Breite 1,6 mm. Vollgesogen sind die Weibchen 8,8 mm lang und 4,6 mm breit. Das Scutum reicht über die Hälfte des Körpers hinaus. Der Körper trägt zahlreiche helle Borstenhaare (⇒ Setae). Das 1,4 mm lange Schild ist kurz hinter der Mitte am breitesten. Die Seitenfelder sind dunkelbraun, die anderen Teile hellbraun. Die Scapulae sind kräftig und spitz, ihre Außenflächen wellig. Auf der ⇒ Basis capituli sind zwei abgerundet dreieckige ⇒ Areae porosae vorhanden. Zudem sind mächtige ⇒ Auriculae vorhanden. Die ⇒ Palpen sind lang und schmal. Ihre Außenseite ist gerade und nur am Ursprung des zweiten Glieds plötzlich zusammengezogen. Die Innenseiten sind gewölbt. Das ⇒ Hypostom ist spitz. Die Enden der 13 bis 14 spitzen Seitenzähne sind leicht nach außen gebogen. In der Mitte am Grund des Hypostoms befindet sich eine auffallend große, zahnlose, dreieckige Fläche. Die Spirakularplatte ist oval mit leicht zackigen Rändern. Die Spirakularöffnung liegt zentral. Die Analfurche ist gut entwickelt und zeigt typischerweise die Form eines Hufeisens. An den ⇒ Coxen des ersten Beinpaares sitzt ein Außen- wie ein Innendorn. An den Coxen der anderen Beine sitzt nur ein Außendorn. Am zweiten und dritten Beinpaar ist dieser deutlich nach innen gebogen, am vierten Beinpaar leicht nach außen. Die Tarsen des ersten Beinpaares sind auffallend lang und dünn und werden zur Spitze hin schmäler.
Weibchen: Der Körper ist oval und kurz hinter der Mitte am breitesten. Es ist eine kleine Zecken-Art, die Körperlänge beträgt nüchtern 3,2 mm, die Breite 1,6 mm. Vollgesogen sind die Weibchen 8,8 mm lang und 4,6 mm breit. Das Scutum reicht über die Hälfte des Körpers hinaus. Der Körper trägt zahlreiche helle Borstenhaare (⇒ Setae). Das 1,4 mm lange Schild ist kurz hinter der Mitte am breitesten. Die Seitenfelder sind dunkelbraun, die anderen Teile hellbraun. Die Scapulae sind kräftig und spitz, ihre Außenflächen wellig. Auf der ⇒ Basis capituli sind zwei abgerundet dreieckige ⇒ Areae porosae vorhanden. Zudem sind mächtige ⇒ Auriculae vorhanden. Die ⇒ Palpen sind lang und schmal. Ihre Außenseite ist gerade und nur am Ursprung des zweiten Glieds plötzlich zusammengezogen. Die Innenseiten sind gewölbt. Das ⇒ Hypostom ist spitz. Die Enden der 13 bis 14 spitzen Seitenzähne sind leicht nach außen gebogen. In der Mitte am Grund des Hypostoms befindet sich eine auffallend große, zahnlose, dreieckige Fläche. Die Spirakularplatte ist oval mit leicht zackigen Rändern. Die Spirakularöffnung liegt zentral. Die Analfurche ist gut entwickelt und zeigt typischerweise die Form eines Hufeisens. An den ⇒ Coxen des ersten Beinpaares sitzt ein Außen- wie ein Innendorn. An den Coxen der anderen Beine sitzt nur ein Außendorn. Am zweiten und dritten Beinpaar ist dieser deutlich nach innen gebogen, am vierten Beinpaar leicht nach außen. Die Tarsen des ersten Beinpaares sind auffallend lang und dünn und werden zur Spitze hin schmäler.
Männchen: Die Männchen sind bis heute nicht ordnungsgemäß beschrieben und nirgendwo abgebildet. Vermutlich sind sie unbekannt, die einzig existierende Fundmeldung eines Männchens, jene von Bona et Stanko [2013], scheint auf einer Verwechslungen zu beruhen. Männchen scheinen gar nicht oder nur sehr kurz Blut zu saugen, und sie werden von den Vögeln nicht vertragen. Es besteht aber auch die Möglichkeit, dass gar keine Männchen existieren und ⇒ Parthenogenese Platz greift.
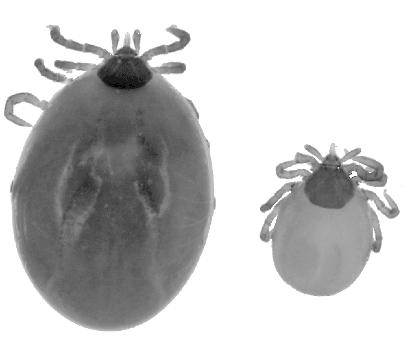 Nymphe: Das Scutum ist längsgestreckt und im vorderen Drittel am breitesten. Die Seitenfelder sind dunkler als der Rest des Scutums. Rechts eine Abbildung von zwei Nymphen dieser Zeckenart, cit. Laakkonen et al. [2009], deren Erscheinungsbild allerdings auffallend schlecht mit der Beschreibung übereinstimmt.
Nymphe: Das Scutum ist längsgestreckt und im vorderen Drittel am breitesten. Die Seitenfelder sind dunkler als der Rest des Scutums. Rechts eine Abbildung von zwei Nymphen dieser Zeckenart, cit. Laakkonen et al. [2009], deren Erscheinungsbild allerdings auffallend schlecht mit der Beschreibung übereinstimmt.
Larve: Das Scutum ist breiter als es lang ist, es ist oval, in der Mitte am breitesten. Die ⇒ Palpen sind lang und breit. Am Ursprung des zweiten Glieds verjüngen sie sich. Die Innenseite ist gerade, die Außenseite deutlich ⇒ konkav gewölbt. Die Nahtlinie zwischen dem zweiten und dem dritten Glied ist nur undeutlich zu erkennen. An den langen und breiten Beinen sitzen viele Borstenhaare (Setae). Die Tarsi des ersten Beinpaares sind massiv, die des zweiten dagegen schmal. Die ⇒ Coxen des ersten Beinpaares haben etwa gleichgroße Innen- und Außendorne. Die des zweiten und dritten Beinpaares nur einen spitzen Außendorn. Die Kapsel des Haller`schen Organs enthält vier Sinnesborsten. Das stärkste schaut durch die Öffnung nach außen.
Verbreitung: I. frontalis ist eine streng ⇒ ornithophile, jedoch frei-lebende Ixodes-Art, die offensichtlich häufig von Zugvögeln verschleppt wird. cit. Laakkonen et al. [2009]. Nach meiner Meinung sind der VErteiler dieser Zecke aber eher Standvögel, denn diese Zeckenart wurde noch nie in Afrika gefunden. Die Art hat wahrscheinlich kein fest umschriebenes Verbreitungsgebiet. Fundpunkte liegen in Südost-England, an der West- und Nordküste Englands, in Frankreich, Belgien, Holland, Deutschland, Dänemark, Norwegen, Polen, Spanien, Italien, Finnland, Türkei bis hinein nach Russland. Die Fundpunkte entsprechen nicht den Hauptrouten des europäischen Vogelzugs. Diese Zecke wird in Zentraleuropa immer wieder gefunden, so zB vor einigen Jahren in Bayern, cit. Schorn et al. [2011], und in der Slowakei. cit. Bona et Stanko [2013], in Deutschland soll sie ubiquitär verbreitet sein. Diese Art wurde 1865 in Niederösterreich aufgesammelt, leider ohne genaue Angabe der Fundumstände. Es existiert ein Belegexemplar im Naturhistorischen Museum Wien.
Bionomie: Die Tiere dieser Art leben nicht in den Vogelnestern, obwohl sie ⇒ ornithophil sind. Sie werden in Nadel- und Laubwäldern, Parkanlagen und Gärten gefunden. Vermutlich leben sie in den obersten Bodenschichten und im Laubstreu. Sie befallen bevorzugt solche Vögel, die am Boden ihr Futter suchen und in Baumnestern brüten.
Wirte aller Stadien: Viele Arten von heimischen Vögeln, besonders bedeutend sind die ziehenden Singvögel.
- Heimische Wirte:
- Anseriformes: Anser anser (Linnaeus, 1758) dt: Graugans.
- Passeriformes: Parus major Linnaeus, 1758 dt: Kohlmeise;
- Turdus merula Linnaeus, 1758 dt: Amsel;
- Sylvia atricapilla (Linnaeus, 1758) dt: Mönchsgrasmücke;
- Cyanistes caeruleus Linnaeus, 1758 dt: Blaumeise;
- Sturnus vulgaris Linnaeus, 1758 dt: Star;
- Poecile montanus (Conrad von Baldenstein, 1827) dt: Weidenmeise;
- Turdus viscivorus Linnaeus, 1758 dt: Misteldrossel;
- Anthus pratensis (Linnaeus, 1758) dt: Wiesenpiper;
- Anthus trivialis Linnaeus, 1758 dt: Baumpiper;
- Acrocephalus palustris (Bechstein, 1798) cit. Siuda et al. [2006];
- Coccothraustes coccothraustes (Linnaeus, 1758) dt: Kernbeißer;
- Carduelis chloris Linnaeus, 1758 dt: Grünfink;
- Fringilla montifringilla Linnaeus, 1758 dt: Bergfink, in Österreich nur Wintergast;
- Garrulus glandarius (Linnaeus, 1758) dt: Eichelhäher;
- Motacilla alba Linnaeus, 1758 dt: Bachstelze;
- Regulus regulus Linnaeus, 1758 dt: Wintergoldhähnchen;
- Emberiza schoeniclus (Linnaeus, 1758) dt: Rohrammer;
- Erithacus rubecula (Linnaeus, 1758) dt: Rotkehlchen;
- Passer montanus (Linnaeus, 1758) dt: Feldsperling;
- Saxicola rubetra (Linnaeus, 1758) dt: Braunkehlchen;
- Turdus merula Linnaeus, 1758 dt: Amsel.
- Gruiformes: Crex crex (Linnaeus, 1758) dt: Wachtelkönig.
Vektorfunktion: I. frontalis fungiert als ⇒ Überträger der Viren Bahig, Kemerovo, Matruh und des Erregers des Q-Fiebers, Coxiella burnetii (Derrick, 1939).
Ixodes (Pholeoixodes) hexagonus Leach, 1815
dt: Igelzecke, en: hedgehog tick
Abb. VIII.5.32: Ixodes hexagonus ♀.
© André Karwath.
Die Igelzecke ist unberechtigterweise eine in Österreich weitgehend unbeachtete Schildzeckenart. Trotz ihrer hohen ⇒ Abundanz wird ihr Vorkommen und ihre Rolle im Ökosystem häufig gänzlich negiert. (REM: Beachte den Namen „rarus” im Synonym Ixodes hexagonus rarus Morel et Pérez, 1973!). Und dies obwohl diese Spezies die am häufigsten gefundene Zecke an Katzen und die zweithäufigste Art (21,7% gegenüber 72% Gemeiner Holzbock; cit. Smith et al. [2011]) an Hunden ist. Diese Ignoranz führt zu Unsicherheiten bei der Zuschreibungen von Beobachtungen und, in diesem speziellen Fall, zu einem heftigen Disput über ihre ⇒ Abundanz. Ich glaube, dass sie auf Grund ihrer Lebensweise - sie ist vermutlich ⇒ nidikol - zumeist am Igel parasitiert, der sicherlich auch der Hauptwirt ist und immer dann bevorzugt befallen wird, wenn er verfügbar ist. Dazu scheint diese Zecken-Art aber, gemeinsam mit dem Igel, ein ⇒ Zivilisationsfolger bis in die Städte hinein zu sein, der auch gerne Hunde und Katzen in Parks und städtischen Naherholungsräumen befällt. Sie wäre somit ein urbaner Zivilisationsgewinner, möglicherweise ist sie sogar ⇒ endophil. In Teilen cit. Dautel et Kahl [1999]. Für den Hausgebrauch gilt: Vom Holzbock unterscheidet man die Igelzecke am einfachsten durch die Form des Tarsus des ersten Beinpaars. Dieser hat bei der Igelzecke einen deutlichen Höcker nahe der Spitze, beim Holzbock verjüngt sie sich gleichmäßig.
Synonyme:
I. autumnalis Leach, 1815;
I. erinacei Audouin, 1832;
I. reduvius Audouin, 1832;
I. crenulatus Koch, 1835;
I. auricularis Robineau-Desvoidy, 1836;
I. sexpunctatus Koch, 1847;
I. vulpis Pagenstecher, 1861;
I. cricuarius Fitch, 1872;
I. erinaceus Murray, 1877;
Euixodes hexagonus Bonnet, 1908;
I. hexagonus Neumann, 1911;
I. hexagonus hexagonus Neumann, 1911;
I. hexagonus pacata Schulze, 1937;
I. autumnalis Schulze, 1941;
I. hexagonus hungaricus Babos, 1964;
I. hexagonus Clifford et al., 1973;
I. hexagonus rarus Morel et Pérez, 1973;
Pholeoixodes hexagonus Morel et Pérez, 1973;
I. hexagonus pacata Doss et Anastos, 1977.
 Weibchen:
Weibchen: 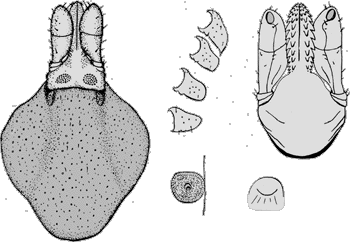 Das Igelzeckenweibchen ist mit einer Größe im nüchternen Zustand von etwa 3,5 bis 4 mm dem Holzbockweibchen meist sehr ähnlich. Der Teil des Rückens, der nicht vom Schild bedeckt ist, ist dünnhäutig, hell gefärbt, manchmal sogar ganz weiß oder lichtgrau. Der Körper ist längsgestreckt oval. Die Anal- und die Genitalfurchen reichen über den Rand des Körpers bis auf den Rücken hinauf. Der Schild ist sechseckig, was der Art den Namen gegeben hat. Die Seitenfelder sind dunkler als die Mitte. Die Scapulae sind stark und spitz. Das Scutum ist mit mittelgroßen Punkten und winzigen Borsten besetzt. Der obere, vordere Rand der ⇒ Basis capituli ist in der Mitte etwas eingebuchtet. Die Basis capituli trägt stumpfe ⇒ Cornua. Die ⇒ Areae porosae sind groß, birnenförmig und teils von einer Chitinleiste umgeben. Die ⇒ Palpen sind kurz und im Aussehen massiv. Ihr Außenrand ist gerade und erst an der Spitze gewölbt, die Innenseite ist gewölbt. Das dritte Palpenglied ist an der Innenseite etwas höher als außen. Die Seitenränder des ⇒ Hypostoms erscheinen mehr oder minder parallel. Das Hypostom endet in einer stumpfen Spitze mit einer kleinen Einschnürung. Die Seitenzähne sind spitz mit eingebogenen Enden. Die Innenzähne sind kleiner und abgerundet. Die Spirakularplatte ist unregelmäßig rund. Im Vergleich zu anderen Ixodes-Arten erscheinen die Beine mittellang und massiv. Die ⇒ Coxen des ersten Beinpaares sind dreieckig und besitzen einen gut entwickelten Innendorn. Die anderen Coxen haben keine Dornen. Die Seiten der Coxen des zweiten Beinpaares verlaufen ungefähr parallel. Die Tarsi des ersten Beinpaares sind hinter dem Haller`schen Organ ausgebuchtet und mit einer rechtwinkeligen Stufe verschmälert. Die Kralle ist erheblich länger als der ⇒ Pulvillus.
Das Igelzeckenweibchen ist mit einer Größe im nüchternen Zustand von etwa 3,5 bis 4 mm dem Holzbockweibchen meist sehr ähnlich. Der Teil des Rückens, der nicht vom Schild bedeckt ist, ist dünnhäutig, hell gefärbt, manchmal sogar ganz weiß oder lichtgrau. Der Körper ist längsgestreckt oval. Die Anal- und die Genitalfurchen reichen über den Rand des Körpers bis auf den Rücken hinauf. Der Schild ist sechseckig, was der Art den Namen gegeben hat. Die Seitenfelder sind dunkler als die Mitte. Die Scapulae sind stark und spitz. Das Scutum ist mit mittelgroßen Punkten und winzigen Borsten besetzt. Der obere, vordere Rand der ⇒ Basis capituli ist in der Mitte etwas eingebuchtet. Die Basis capituli trägt stumpfe ⇒ Cornua. Die ⇒ Areae porosae sind groß, birnenförmig und teils von einer Chitinleiste umgeben. Die ⇒ Palpen sind kurz und im Aussehen massiv. Ihr Außenrand ist gerade und erst an der Spitze gewölbt, die Innenseite ist gewölbt. Das dritte Palpenglied ist an der Innenseite etwas höher als außen. Die Seitenränder des ⇒ Hypostoms erscheinen mehr oder minder parallel. Das Hypostom endet in einer stumpfen Spitze mit einer kleinen Einschnürung. Die Seitenzähne sind spitz mit eingebogenen Enden. Die Innenzähne sind kleiner und abgerundet. Die Spirakularplatte ist unregelmäßig rund. Im Vergleich zu anderen Ixodes-Arten erscheinen die Beine mittellang und massiv. Die ⇒ Coxen des ersten Beinpaares sind dreieckig und besitzen einen gut entwickelten Innendorn. Die anderen Coxen haben keine Dornen. Die Seiten der Coxen des zweiten Beinpaares verlaufen ungefähr parallel. Die Tarsi des ersten Beinpaares sind hinter dem Haller`schen Organ ausgebuchtet und mit einer rechtwinkeligen Stufe verschmälert. Die Kralle ist erheblich länger als der ⇒ Pulvillus.
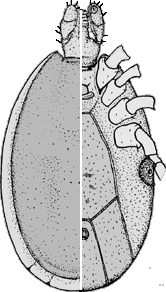
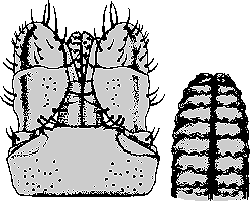 Männchen: Der ovale Körper ist viel kleiner als der des Weibchens. Der Schild ist oval, einheitlich und dicht punktiert. Die bauchseitigen Platten sind auffällig: Die Prägenitalplatte, das ist die Platte vor der ⇒ Genitalöffnung, ist Y-förmig; dies ist das diagnostische Merkmal der Männchen dieser Art. Allerdings ist dieses Merkmal nicht immer leicht zu erkennen und auch in der Abbildung links nicht visualisiert. Die ⇒ Palpen sind kurz und massiv, an ihrem Ursprung schmaler. Das Hypostom hat am Grunde parallel Seiten, am Ende verjüngt es sich zu einer stumpfen Spitze. Die Zähne sind zu sieben bis acht welligen, parallel verlaufenden Querkämmen verwachsen. Die Beine sind ähnlich geformt wie die des Weibchens, die ⇒ Coxen des ersten Beinpaares sind aber etwas gedrungener und der Innendorn ist länger.
Männchen: Der ovale Körper ist viel kleiner als der des Weibchens. Der Schild ist oval, einheitlich und dicht punktiert. Die bauchseitigen Platten sind auffällig: Die Prägenitalplatte, das ist die Platte vor der ⇒ Genitalöffnung, ist Y-förmig; dies ist das diagnostische Merkmal der Männchen dieser Art. Allerdings ist dieses Merkmal nicht immer leicht zu erkennen und auch in der Abbildung links nicht visualisiert. Die ⇒ Palpen sind kurz und massiv, an ihrem Ursprung schmaler. Das Hypostom hat am Grunde parallel Seiten, am Ende verjüngt es sich zu einer stumpfen Spitze. Die Zähne sind zu sieben bis acht welligen, parallel verlaufenden Querkämmen verwachsen. Die Beine sind ähnlich geformt wie die des Weibchens, die ⇒ Coxen des ersten Beinpaares sind aber etwas gedrungener und der Innendorn ist länger.
Nymphe und Larve: Die Nymphen ähneln den Weibchen, nur der Innendorn an den ⇒ Coxen des ersten Beinpaares sind kleiner. Das Hypostom hat weniger Zähne. Die Coxen der Larven dagegen haben keine Dornen.
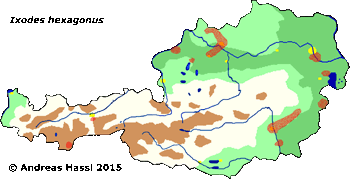
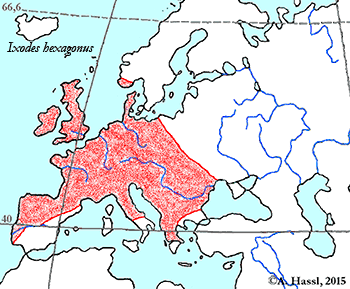 Verbreitung: I. hexagonus kommt sicher in West-, Mittel- und Südosteuropa vor. Da vor allem in populärwissenschaftlicher Literatur diese Art selten von I. ricinus differenziert wird, sind die Meldungen von Funden der Igelzecke in Relation zu ihrer hohen ⇒ Abundanz eher spärlich. Die Angaben schwanken von Autor zu Autor, höchstwahrscheinlich kommt diese Zecke in Irland, England, Südnorwegen, Dänemark, Portugal, Spanien, Frankreich, Deutschland, Holland, Belgien, der Schweiz, Italien, Österreich, der Tschechischen Republik und, flächendeckend, in Polen vor. Auch aus Rumänien, Griechenland und der Westukraine liegen Fundmeldungen vor. Unter der Annahme, dass es sich um einen ⇒ nidikolen Spezialisten in den Bauten des Braunbrustigels handelt, fehlen in der ersten Aufzählung allerdings die Region um Sankt Petersburg, Finnland und Schweden. Griechenland, Rumänien und die Ukraine sind hingegen ein kleiner Teil des Verbreitungsgebietes des Nördlichen Weißbrustigels, das sich bis tief nach Zentralasien erstreckt. Es ist unklar, ob es sich bei der Igelzecke um einen monophagen Parasiten des Braunbrustigels handelt und die Funde in den letztgenannten Staaten Fehlbestimmungen sind, oder ob das Verbreitungsgebiet der Zecke jene der beiden Igelarten inkludiert und aus Osteuropa und Zentralasien lediglich die Fundmeldungen fehlen. Diese Zecken-Art ist wahrscheinlich in ganz Österreich verbreitet. Als höchster Fundort wird Obergurgl auf 1800 m Seehöhe angegeben, die Zecke parasitierte auf einer Alpenspitzmaus.
Verbreitung: I. hexagonus kommt sicher in West-, Mittel- und Südosteuropa vor. Da vor allem in populärwissenschaftlicher Literatur diese Art selten von I. ricinus differenziert wird, sind die Meldungen von Funden der Igelzecke in Relation zu ihrer hohen ⇒ Abundanz eher spärlich. Die Angaben schwanken von Autor zu Autor, höchstwahrscheinlich kommt diese Zecke in Irland, England, Südnorwegen, Dänemark, Portugal, Spanien, Frankreich, Deutschland, Holland, Belgien, der Schweiz, Italien, Österreich, der Tschechischen Republik und, flächendeckend, in Polen vor. Auch aus Rumänien, Griechenland und der Westukraine liegen Fundmeldungen vor. Unter der Annahme, dass es sich um einen ⇒ nidikolen Spezialisten in den Bauten des Braunbrustigels handelt, fehlen in der ersten Aufzählung allerdings die Region um Sankt Petersburg, Finnland und Schweden. Griechenland, Rumänien und die Ukraine sind hingegen ein kleiner Teil des Verbreitungsgebietes des Nördlichen Weißbrustigels, das sich bis tief nach Zentralasien erstreckt. Es ist unklar, ob es sich bei der Igelzecke um einen monophagen Parasiten des Braunbrustigels handelt und die Funde in den letztgenannten Staaten Fehlbestimmungen sind, oder ob das Verbreitungsgebiet der Zecke jene der beiden Igelarten inkludiert und aus Osteuropa und Zentralasien lediglich die Fundmeldungen fehlen. Diese Zecken-Art ist wahrscheinlich in ganz Österreich verbreitet. Als höchster Fundort wird Obergurgl auf 1800 m Seehöhe angegeben, die Zecke parasitierte auf einer Alpenspitzmaus.
Bionomie: Der Hauptwirt ist vermutlich ausschließlich der Igel, wobei ich davon ausgehe, dass beide europäischen Igelarten, der Braunbrustigel (Erinaceus europaeus) und der Nördliche Weißbrustigel (Erinaceus roumanicus) ohne Unterschied von der Zecke befallen werden. Allgemein akzeptiert ist die Ansicht, dass die Igelzecke an Wirte gebunden ist, die ein festes, immer wieder aufgesuchtes ⇒ Habitat bewohnen. Die verschiedenen Stadien wurden immer nur auf ihren Wirtstieren gefunden, das Auftreten hängt mit den Lebensgewohnheiten und den Aktivitätsphasen der Wirte zusammen. Auf der Budapester Stadtinsel, einem urbanen Lebensraum, wurden fast 80% der Igel mit dieser Zecken-Art infestiert gefunden, mit einer Parasitenlast von durchschnittlich 32 Zecken pro Igel. Durchschnittlich sind aber nur 53,3% der Igel mit Igelzecken und 23,4% mit Holzböcken infestiert. Die Auftreten und die pathogene Wirkung eines Massenbefalls sind umstritten (siehe unten). cit. Pfäffle et al. [2011]. Adulte Igelzecken findet man von Jänner bis Juni, Nymphen von Jänner bis Oktober, und Larven von April bis Oktober. Die Zeitdauer zwischen der Blutmahlzeit der Nymphe und der Häutung zum Adulttier beträgt im Sommer in ⇒ Zentraleuropa 19 Tage. cit. Nosek et al. [1967]. Männchen werden auffällig selten auf den Wirtstieren gefunden, die anderen Stadien werden hingegen fast ausschließlich nur auf dem Wirt gefunden. Diese Beobachtung ist allerdings mit höherer Wahrscheinlich keit auf die Sammeltechniken zurück zu führen, denn auf eine sich andeutende stationäre Lebensweise dieses als drei-wirtig angesehenen Parasiten. Das Habitat dieser Art ist der Rücken und die Analregion des Wirtes.
Die Igelzecke lebt die meiste Zeit ihres Lebens im Bau ihres Wirtes, sie ist also ⇒ nidikol. Zumindest der Braunbrustigel hält einen Winterschlaf. In den Torporphasen dieser Ruhezeit sackt seine Körpertemperatur auf ein bis acht Grad ab, der Herzschlag verlangsamt sich stark und die Atmung wird auf wenige Atemzüge pro Minute reduziert. Daraus ergibt sich, dass die Zecke, obwohl nidikol, sicherlich nicht ganzjährig aktiv ist - zumindest kann sie ganz sicher aufgenommenes Blut im Winter nicht verdauen und sich deshalb nicht weiterentwickeln. Vermutlich liegt in diesem Fall der Vorteil der nidikolen Lebensweise in einem geringeren Aufwand bei der Wirtssuche durch die rezidivierende Verfügbarkeit des aktiven Wirtes im Sommerhalbjahr. Im Jahreslauf findet man die meisten Igelzecken im April und Mai und dann wieder im September und Oktober. Die Saison reicht allerdings vom März bis in den November. Adulte Igelzecken findet man in Österreich von Jänner bis Juni, Nymphen von Jänner bis Oktober, und Larven von April bis Oktober.
Nicht ganz so einfach lässt sich die Behauptung einer Nachtaktivität dieser Zecke erklären. Da Zecken der Gattung Ixodes keine Augen besitzen und diese Art überdies nidikol ist, wird nur ein Zusammenhang mit der täglichen Aktivitätszeit des Hauptwirtes, des Igels, postuliert. Die Zecken verlassen ihren Wirt in der Regel im Dunkeln, und sie saugen während des späten Abends und in den frühen Morgenstunden. Diese Beobachtung ist dann konsistent mit der Tatsache eines nachtaktiven Wirtes, wenn dieses Verhalten das Risiko der Verschleppung der Zecke aus dem Bau verringern sollte. Alternativ kann dieses Verhalten auch ein Ausfluss der jahreszeitlichen Aktivität der Zecken sein: Während der Zeit des Winterschlafs des Wirtes und der damit einhergehenden Dauerfinsternis verlässt die Zecke den Wirt und überdauert im Nestmaterial oder in Bodenspalten. Auf dem Wirt zu überwintern bringt der Zecke keinen Vorteil, da dieser phasenweise Umgebungstemperatur hat. Diese Zecken werden durch Fäkalgerüche angezogen, wobei stark parasitierte, vielleicht immunsupprimierte Igel offenbar für Zecken besser riechen als gesunde, wenig bis nicht parasitierte. Dies sollte logischerweise zu Massenbefall einzelner Individuen führen. Allerdings tritt nach Meinung anderer Autoren ein so massiver Befall des Igels nicht auf, dass man Symptome einer Erkrankung oder einer Immunsuppression beobachten könnte. Damit lässt sich nun die Ursache und der Erfolg nicht mehr klar voneinander abgrenzen - und das Auftreten eines Massenbefalls eines Wirtsindividuums mit Igelzecken wird von einigen Beobachtern überhaupt bezweifelt. Es scheint eher so zu sein, dass es bei der Igelzecke, im Unterschied zum Gemeinen Holzbock, einen dichteabhängigen Repellent-Mechanismus zumindest bei einem Befall des optimalen Wirts gibt. cit. Pfäffle et al. [2011]. Es handelt sich vermutlich um einen urbanen ⇒ Zivilisationsfolger, der in Parks und Gärten, in Österreich bis 1800m Seehöhe, lebt. Diese Zecken-Art kann angeblich bis zu fünf Jahren ohne Nahrung auskommen, der biologische Sinn dieser Fähigkeit ist bei einem ⇒ nidikolen Nahrungsspezialisten an einem ⇒ ubiquitären und häufigen Säugetier jedoch nicht ersichtlich.
Wirte aller Stadien: Der Hauptwirt ist der Igel. Daneben werden auch noch fleischfressende und andere Säugetiere als Wirte akzeptiert, niemals aber Vögel. Akzidentell wird auch der Mensch attackiert.
- Heimische Wirte:
- Primates: Homo sapiens Linnaeus, 1758 dt: Mensch.
- Carnivora: Canis lupus familiaris (Linnaeus, 1758) dt: Haushund;
- Vulpes vulpes (Linnaeus, 1758) dt: Rotfuchs;
- Meles meles (Linnaeus, 1758) dt: Europäischer Dachs;
- Felis sylvestris f. catus (Linnaeus, 1758) dt: Hauskatze;
- Martes foina (Erxleben, 1777) dt: Steinmarder;
- Mustela putorius Linnaeus, 1758 dt: Europäischer Iltis;
- Lutra lutra (Linnaeus, 1758) dt: Fischotter.
- Artiodactyla: Cervus elaphus Linnaeus, 1758 dt: Rothirsch.
- Eulipotyphla: Erinaceus europaeus Linnaeus, 1758 dt: Braunbrustigel;
- Erinaceus roumanicus Barrett-Hamilton, 1900 dt: Nördlicher Weißbrustigel. cit. Nosek et al. [1967]
- Eulipotyphla: Sorex alpinus Schinz 1837 dt: Alpenspitzmaus;
- Sorex minutus Linnaeus, 1766 dt: Zwergspitzmaus.
- Rodentia: Sciurus vulgaris Linnaeus, 1758 dt: Eichhörnchen;
- Myodes glareolus (Schreber, 1780) dt: Rötelmaus.
Vektorfunktion: 28% der Igelzecken tragen Borrelia burgdorferi s.l. Johnson et al., 1984 emend. Baranton et al., 1992, in sich. Andere europäische Erreger der Lyme-Borreliose wie Borrelia valaisiana Wang et al., 1997, Borrelia spielmanii Richter et al., 2006, Borrelia lusitaniae Le Fleche et al., 1997 wurden in Igelzecken nachgewiesen, ebenso wie Borrelia afzelii Canica et al., 1994, den Erreger einer Hautborreliose und Borrelia garinii Baranton et al., 1992, den Erreger der Neuroborreliose. Diese Zecken-Art kann die Borrelien auch ⇒ transovariell weitergeben. Außerdem überträgt diese Zecke das Virus der Frühsommer-Meningoenzephalitis (FSME) und das Erve-Fieber Virus. Zudem wurden in Igelzecken Rickettsia conorii Brumpt, 1932, der Erreger des Mittelmeerfleckfiebers, Rickettsia helvetica Beati et al., 1993, ein unbestätigter Erreger einer Meningitis, Anaplasma phagocytophila (Foggie, 1949) Dumler et al., 2001, der Erreger der Granulozytären Ehrlichiose und Babesia microti Franca, 1912 = heute: Theileria microti, ein Babesioseerreger nachgewiesen. In Spanien wurde Babesia vulpes (Zahler et Rinder et Schein et Gothe, 2000), (Synonym: Theileria annae) in den Zecken gefunden, diese können eine Anämie beim Hund hervorrufen.
Da die Igelzecke den Menschen selten sticht, wird die Vektorfunktion dieser Spezies im Zusammenhang mit menschlichen Erkrankungen als wenig bedeutend eingestuft. Es wird aber postuliert, dass sie ein besonderes Risiko darstellt, weil sie die ganzjährige (?), stabile Existenz eines Erregerpools in den Hausgärten ermöglicht und damit im urbanen Umfeld Menschen einem Infektionsrisiko aussetzt, die sonst nie mit Zecken in Kontakt kommen. Es scheint daher ihre Funktion als Reservoirwirte von erheblicher Bedeutung zu sein, insbesondere bei der Etablierung und Aufrechterhaltung von urbanen Zyklen von Zecken-übertragenen, ⇒ euryxenen Erregern.
Ixodes inopinatus Estrada-Peña, Nava et Petney, 2014
Abb. VIII.5.33: Ixodes inopinatus ♀.
© Gerhard Dobler.
Diese Zeckenart verdrängt unstrittig in Südwesteuropa und Nordwestafrika die nahe verwandte, jedoch eindeutig differenzierbare Art I. ricinus, zumindest in den trockenen ⇒ Habitaten. Obwohl erst 2014 beschrieben und somit in ihrer Bionomie noch weitgehend unbekannt, erscheint diese Art den Gemeinen Holzbock in Andalusien und Nordafrika so vollständig zu ersetzen, dass ernsthafte Zweifel über das - bis dato als gesichert angesehene - Vorkommen des Holzbocks in Nordafrika bestehen. Ich bin allerdings überzeugt, dass sich die von den beiden Arten bevorzugten Mikrohabitate in ihrer ⇒ Aridität deutlich unterscheiden. Ich glaube, dass ein klassischer Fall einer ⇒ allopatrischen Artentstehung während der letzten Eiszeit vorliegt, mit einer postglazialen Verschleppung der Art nach Zentraleuropa. Es handelt sich um eine relativ kleine Ixodes-Art, die jedoch in allen Stadien bestimmt und von anderen Arten differenziert werden kann.
Synonyme: Bisher sind synonyme Benennungen nicht bekannt geworden.
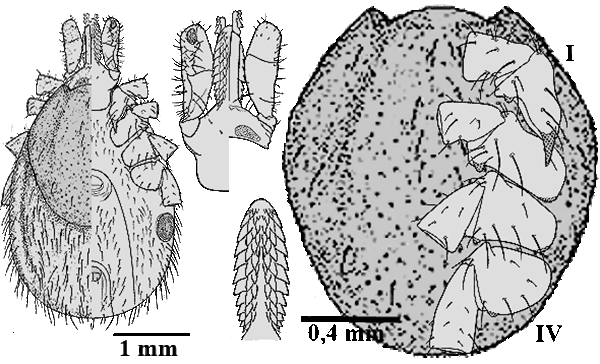 Weibchen: Nüchterne Weibchen sind ohne Capitulum durchschnittlich 3,63 mm lang und 1,9 mm breit. Der Umriss des ⇒ Scutums ist grob rundlich, 1,34 mm lang und 1,18 mm breit. Am Schild fehlen die ⇒ Zervikalfurchen oder sie sind nur sehr schwach ausgebildet, die Punktierung ist verstreut und zentral am stärksten ausgeprägt und das Schild ist mit nach dem Zufallsprinzip verstreuten, feinen Borstenhaaren (⇒ Setae) bedeckt. Die ⇒ Scapulae werden in der Originalbeschreibung (cit. Estrada-Peña et al. [2014]) nicht erwähnt, in der zugrundeliegenden Abbildung sind sie jedoch deutlich erkennbar, spitz und nach vorne gerichtet. Das ⇒ Capitulum ist von den Palpenspitzen bis zur Basis 540 bis 590 μm lang, die ⇒ Basis capituli ist dorsal 430 μm breit, der hintere Rand breit ausgeformt und konkav, die ⇒ Cornua sind klein, aber vorhanden. Die ⇒ Areae porosae haben einen irregulär dreieckigen Umriss, der vordere Rand ist breit gerundet, der hintere gerade und gut abgrenzbar. Die ⇒ Palpen sind 460 bis 540 μm lang und 160 μm breit. Das zweite Palpenglied ist länger als das dritte.
Weibchen: Nüchterne Weibchen sind ohne Capitulum durchschnittlich 3,63 mm lang und 1,9 mm breit. Der Umriss des ⇒ Scutums ist grob rundlich, 1,34 mm lang und 1,18 mm breit. Am Schild fehlen die ⇒ Zervikalfurchen oder sie sind nur sehr schwach ausgebildet, die Punktierung ist verstreut und zentral am stärksten ausgeprägt und das Schild ist mit nach dem Zufallsprinzip verstreuten, feinen Borstenhaaren (⇒ Setae) bedeckt. Die ⇒ Scapulae werden in der Originalbeschreibung (cit. Estrada-Peña et al. [2014]) nicht erwähnt, in der zugrundeliegenden Abbildung sind sie jedoch deutlich erkennbar, spitz und nach vorne gerichtet. Das ⇒ Capitulum ist von den Palpenspitzen bis zur Basis 540 bis 590 μm lang, die ⇒ Basis capituli ist dorsal 430 μm breit, der hintere Rand breit ausgeformt und konkav, die ⇒ Cornua sind klein, aber vorhanden. Die ⇒ Areae porosae haben einen irregulär dreieckigen Umriss, der vordere Rand ist breit gerundet, der hintere gerade und gut abgrenzbar. Die ⇒ Palpen sind 460 bis 540 μm lang und 160 μm breit. Das zweite Palpenglied ist länger als das dritte.
Ventral liegt die Geschlechtsöffnung auf der Höhe der vierten Coxen. Die Spirakularplatten sind sub-rundlich mit einem Durchmesser von 370 μm bis 410 μm. Die ⇒ Basis capituli ist ventral mit einem leicht konvexen Hinterrand und mit deutlichen, Grat-förmigen ⇒ Aurikeln versehen. Das ⇒ Hypostom ist 430 bis 460 μm lang und 160 μm breit. Es endet stumpf und ist in der Mitte am breitesten. Es trägt zwölf Querreihen von Zähnen. Die Zahnformel lautet für die vordere Hälfte 4-4 ohne freie Rinne, mittig 3-3 und für die proximal stehenden zwei Reihen 2-2. Alle Zähne sind spitz, die basal und die median stehenden sind klein.
Die Beine sind dünn, mittelmäßig lang und schwarz gefärbt. Alle Beincoxen tragen sehr kleine Außendornen, jener der Coxa IV kann gelegentlich nicht erkennbar sein. Die Beincoxen des ersten Beinpaares tragen außerdem je einen gut entwickelten, langen, sich verjüngenden und sich nur gering nach außen krümmenden Innendorn, der in vivo die Coxa II überdeckt. An den anderen Coxen fehlen die Innendornen. Der Trochanter ist Dornen-los.

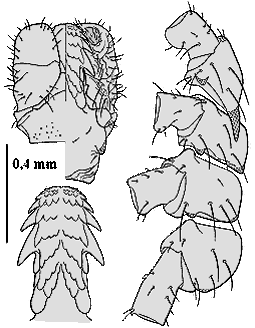 Männchen: Die Beschreibung der Männchen dieser Art ist vorläufig, da bisher noch nie eine Kopulation beobachtet wurde. Die Länge der Tiere, gemessen ohne Mundwerkzeuge, beträgt 2 bis 2,13 mm, ihre Breite 1,1 bis 1,29 mm. Der Körper ist oval, am breitesten auf der Höhe der ⇒ Spirakularplatten. Das ⇒ Scutum ist etwa 2 mm lang (REM: Durch den Autor korrigiertes Maß entgegen der Literaturstelle; cit. Estrada-Peña et al. [2014]) und durchschnittlich 1,09 mm breit. Die ⇒ Scapulae sind rund. ⇒ Zervikalfurchen fehlen oder sind nur sehr schwach ausgebildet. Das ⇒ Capitulum mitsamt der ⇒ Palpen ist von oben gesehen etwa 420 μm lang, die ⇒ Basis capituli misst 150 mal 360 μm, ihr hinterer Rand ist gerade und die äußeren Ränder streben nach vorne auseinander. ⇒ Cornua fehlen. Die Länge und die Breite der ⇒ Palpen sind 300 und 150 μm, das ⇒ Hypostom ist 170 μm lang und 130 μm breit. Die Zahnformel ist 4-4 in den meisten Reihen mit an der Basis einigen irregulären Reihen sehr kleiner Zähnchen. Die äußeren Zähne sind sehr viel größer und deutlich eckiger als die inneren.
Männchen: Die Beschreibung der Männchen dieser Art ist vorläufig, da bisher noch nie eine Kopulation beobachtet wurde. Die Länge der Tiere, gemessen ohne Mundwerkzeuge, beträgt 2 bis 2,13 mm, ihre Breite 1,1 bis 1,29 mm. Der Körper ist oval, am breitesten auf der Höhe der ⇒ Spirakularplatten. Das ⇒ Scutum ist etwa 2 mm lang (REM: Durch den Autor korrigiertes Maß entgegen der Literaturstelle; cit. Estrada-Peña et al. [2014]) und durchschnittlich 1,09 mm breit. Die ⇒ Scapulae sind rund. ⇒ Zervikalfurchen fehlen oder sind nur sehr schwach ausgebildet. Das ⇒ Capitulum mitsamt der ⇒ Palpen ist von oben gesehen etwa 420 μm lang, die ⇒ Basis capituli misst 150 mal 360 μm, ihr hinterer Rand ist gerade und die äußeren Ränder streben nach vorne auseinander. ⇒ Cornua fehlen. Die Länge und die Breite der ⇒ Palpen sind 300 und 150 μm, das ⇒ Hypostom ist 170 μm lang und 130 μm breit. Die Zahnformel ist 4-4 in den meisten Reihen mit an der Basis einigen irregulären Reihen sehr kleiner Zähnchen. Die äußeren Zähne sind sehr viel größer und deutlich eckiger als die inneren.
Auf der ⇒ Ventralseite sind die Prägenital- und die Medianplatte am stärksten punktiert. Die Geschlechtsöffnung liegt auf der Höhe der Coxa III und die ⇒ Spirakularplatten sind leicht länglich geformt und durchschnittlich 310 μm lang und 290 μm breit. Der ventrale Umriss der ⇒ Basis capituli ist mit leicht seitlich abstehenden ⇒ Aurikeln versehen und einem zentral gelegenen Vorsprung nach hinten.
Die Beine sind mittelmäßig lang und schwarz gefärbt. Die Coxen I bis III tragen immer jeweils einen äußeren Dorn (REM: Durch den Autor korrigierte Angabe entgegen der Literaturstelle; cit. Estrada-Peña et al. [2014]), dieser findet sich an Coxa IV nur andeutungsweise. Die Coxa I trägt einen langen, sich verjüngenden, spitzen und leicht gekrümmten Innendorn, auf den Coxen II bis IV findet man niemals einen Innendorn, gelegentlich aber eine leichte Erhöhung. Der Trochanter ist Dornen-los.
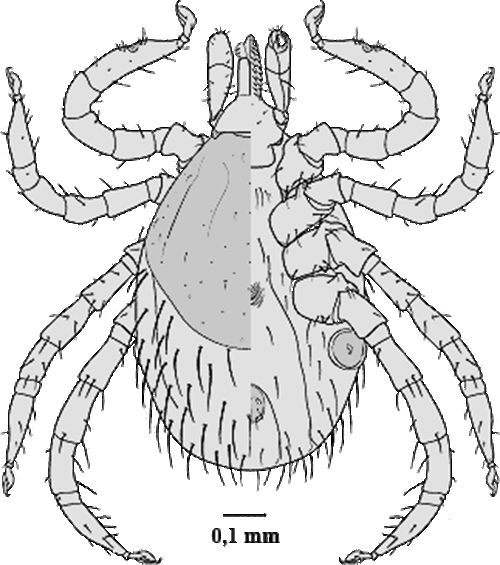
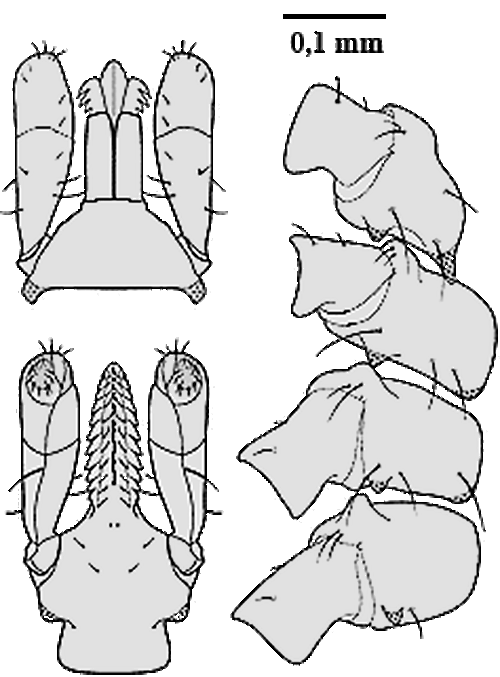 Nymphe: Nüchterne Nymphen sind 1 bis 1,3 mm lang und 0,66 bis 0,93 mm breit. Ihr Körper ist länglich und leicht tropfenförmig. Das Schild ist 510 bis 550 μm lang und 560 bis 590 μm breit und leicht pyramidenförmig geformt. Die ⇒ Scapulae sind kurz und rund, die ⇒ Zervikalfurchen lang und divergierend. Die ⇒ Spirakularplatten sind rundlich und 130 bis 140 μm weit. Das Gnathosoma ist 340 μm lang, die ⇒ Basis capituli ist dreieckig und ihr posteriorer Rand ist gerade. Die ⇒ Cornua sind massiv ausgebildet, weit und spitz. ⇒ Aurikeln sind deutlich ausgebildet, gerade und spitz. Die ⇒ Palpen sind 290 bis 310 μm lang und 160 μm breit. Das zweite Glied ist etwas länger als das dritte. Die äußeren Seiten der ⇒ Palpen sind mehr oder weniger gerade, die innere gewölbt. Das 280 bis 330 μm lange Hypostom ist ungefähr in der Mitte am breitesten und endet spitz. Es sind elf bis zwölf Querreihen an spitzen Zähnen vorhanden. Die Zahnformel lautet 3-3 am vorderen Drittel des Hypostoms, dahinter 2-2 (cit. Estrada-Peña et al. [2014]). In einer anderen, später verfassten Abbildung sind allerdings 2-2 spitze, eckige Zähne in insgesamt 11 bis 12 Reihen zu erkennen (cit. Estrada-Peña A et al. [2017]). Die Beine sind mittelmäßig lang. Die erste Coxa trägt einen kurzen, geraden Außendorn und einen gut entwickelten, spitzen Innendorn, der allerdings in vivo die Coxa II nicht erreicht. Alle Innendornen sind etwas länger als die äußeren. Die Länge der Außendornen verringert sich von Coxa II bis IV, wobei jener der Coxa IV kaum mehr erkennbar ist. An den Trochantern finden sich nie Dornen.
Nymphe: Nüchterne Nymphen sind 1 bis 1,3 mm lang und 0,66 bis 0,93 mm breit. Ihr Körper ist länglich und leicht tropfenförmig. Das Schild ist 510 bis 550 μm lang und 560 bis 590 μm breit und leicht pyramidenförmig geformt. Die ⇒ Scapulae sind kurz und rund, die ⇒ Zervikalfurchen lang und divergierend. Die ⇒ Spirakularplatten sind rundlich und 130 bis 140 μm weit. Das Gnathosoma ist 340 μm lang, die ⇒ Basis capituli ist dreieckig und ihr posteriorer Rand ist gerade. Die ⇒ Cornua sind massiv ausgebildet, weit und spitz. ⇒ Aurikeln sind deutlich ausgebildet, gerade und spitz. Die ⇒ Palpen sind 290 bis 310 μm lang und 160 μm breit. Das zweite Glied ist etwas länger als das dritte. Die äußeren Seiten der ⇒ Palpen sind mehr oder weniger gerade, die innere gewölbt. Das 280 bis 330 μm lange Hypostom ist ungefähr in der Mitte am breitesten und endet spitz. Es sind elf bis zwölf Querreihen an spitzen Zähnen vorhanden. Die Zahnformel lautet 3-3 am vorderen Drittel des Hypostoms, dahinter 2-2 (cit. Estrada-Peña et al. [2014]). In einer anderen, später verfassten Abbildung sind allerdings 2-2 spitze, eckige Zähne in insgesamt 11 bis 12 Reihen zu erkennen (cit. Estrada-Peña A et al. [2017]). Die Beine sind mittelmäßig lang. Die erste Coxa trägt einen kurzen, geraden Außendorn und einen gut entwickelten, spitzen Innendorn, der allerdings in vivo die Coxa II nicht erreicht. Alle Innendornen sind etwas länger als die äußeren. Die Länge der Außendornen verringert sich von Coxa II bis IV, wobei jener der Coxa IV kaum mehr erkennbar ist. An den Trochantern finden sich nie Dornen.
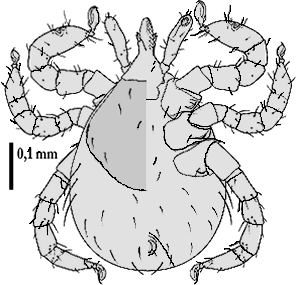
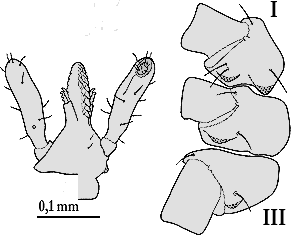 Larve: Die Larven von I. inopinatus sind 0,6 bis 0,7 mm lang und 0,5 bis 0,6 mm breit. Am breitesten sind sie am hinteren Ende des schwach ausgeprägt fünfeckigen bis breit rundlichen Scutums. Das Scutum misst 330 mal 380 μm. Auf dem Scutum stehen unregelmäßig verteilt fünf Paare Borstenhaaren (Setae). Die Scapulae sind kaum erkennbar. Das ⇒ Capitulum ist 190 bis 210 μm lang. Die ⇒ Palpen sind 160 bis 170 μm lang und länglich. Die Nahtlinie zwischen dem zweiten und dem dritten Glied ist nicht zu erkennen. Die äußeren Seiten der ⇒ Palpen sind mehr oder weniger gerade, die innere gewölbt. Die ⇒ Basis capituli ist dreieckig und ihr posteriorer Rand ist leicht konvex gebogen. ⇒ Cornua fehlen. Das Hypostom ist etwa 140 μm lang, langgestreckt mit einer abgerundeten Spitze. Die Zahnformel lautet 3-3 am vorderen Drittel des Hypostoms, dahinter 2-2 in insgesamt 10 Reihen scharf zugespitzter Zähne. Die Beincoxa I trägt zwei dreieckige Dornen, die Coxa II einen äußeren Dorn, die Coxa III ist ohne Dornen.
Larve: Die Larven von I. inopinatus sind 0,6 bis 0,7 mm lang und 0,5 bis 0,6 mm breit. Am breitesten sind sie am hinteren Ende des schwach ausgeprägt fünfeckigen bis breit rundlichen Scutums. Das Scutum misst 330 mal 380 μm. Auf dem Scutum stehen unregelmäßig verteilt fünf Paare Borstenhaaren (Setae). Die Scapulae sind kaum erkennbar. Das ⇒ Capitulum ist 190 bis 210 μm lang. Die ⇒ Palpen sind 160 bis 170 μm lang und länglich. Die Nahtlinie zwischen dem zweiten und dem dritten Glied ist nicht zu erkennen. Die äußeren Seiten der ⇒ Palpen sind mehr oder weniger gerade, die innere gewölbt. Die ⇒ Basis capituli ist dreieckig und ihr posteriorer Rand ist leicht konvex gebogen. ⇒ Cornua fehlen. Das Hypostom ist etwa 140 μm lang, langgestreckt mit einer abgerundeten Spitze. Die Zahnformel lautet 3-3 am vorderen Drittel des Hypostoms, dahinter 2-2 in insgesamt 10 Reihen scharf zugespitzter Zähne. Die Beincoxa I trägt zwei dreieckige Dornen, die Coxa II einen äußeren Dorn, die Coxa III ist ohne Dornen.
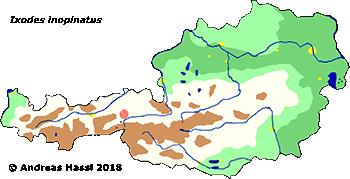
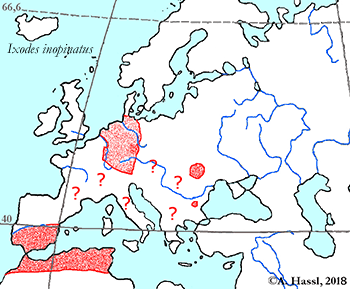 Verbreitung: Das bislang bekannte Vorkommensgebiet von I. inopinatus umfasste Südspanien, Portugal, Deutschland, Österreich, Rumänien, Marokko, Algerien und Tunesien. I. inopinatus und I. ricinus wurden 2019 in Tunesien und auch in Rumänien ⇒ sympatrisch lebend nachgewiesen. cit. Younsi et al. [2019]. In einer Screening-Untersuchung erwiesen sich in Norddeutschland 4% der aufgesammelten Holzböcke als I. inopinatus. cit. Hauck et al. [2019]. Nicht klar ist, ob die beiden Zeckenarten im gleichen Habitat leben oder nur beim großflächigen Absammeln gleichzeitig aufgegriffen werden. Individuen dieser Zecke wurden in Europa auch im Rheinland und der Oberpfalz gefunden, sowie in Österreich im Pinzgau, und in Südrumänien und der Bukowina. cit. Estrada-Peña et al. [2014]; Chitimia-Dobler et al. [2018].
Verbreitung: Das bislang bekannte Vorkommensgebiet von I. inopinatus umfasste Südspanien, Portugal, Deutschland, Österreich, Rumänien, Marokko, Algerien und Tunesien. I. inopinatus und I. ricinus wurden 2019 in Tunesien und auch in Rumänien ⇒ sympatrisch lebend nachgewiesen. cit. Younsi et al. [2019]. In einer Screening-Untersuchung erwiesen sich in Norddeutschland 4% der aufgesammelten Holzböcke als I. inopinatus. cit. Hauck et al. [2019]. Nicht klar ist, ob die beiden Zeckenarten im gleichen Habitat leben oder nur beim großflächigen Absammeln gleichzeitig aufgegriffen werden. Individuen dieser Zecke wurden in Europa auch im Rheinland und der Oberpfalz gefunden, sowie in Österreich im Pinzgau, und in Südrumänien und der Bukowina. cit. Estrada-Peña et al. [2014]; Chitimia-Dobler et al. [2018].
Bionomie: Diese Zecke ist eine exophile Art. Sie lässt sich mittels „flagging” aufsammeln. cit. Chitimia-Dobler et al. [2017]. In Zentraleuropa wurde sie in Mischwäldern durch „flagging” nachgewiesen, die hauptsächlichen Wirte in Zentraleuropa können bislang nur erschlossen werden. Es scheint so, dass diese Zecke in Zentraleuropa als Larve und Nymphe an Eidechsen, speziell der Mauereidechse Podarcis muralis, der Zauneidechse Lacerta agilis, der Östliche Smaragdeidechse Lacerta viridis und der Mooreidechse Zootoca vivipara parasitiert. Der wichtigste Wirt der Adulten in Zentraleuropa ist vermutlich noch nicht erkannt worden. Bekannt geworden sind Adulttiere saugend an Schafen und an Füchsen. Ich glaube aber, dass der Fuchs wegen der Konkurrenz dieser Art mit der vermutlich überlegenen Fuchszecke nicht der hauptsächliche Wirt sein kann.
Wirte: Es ist anzunehmen, dass das Wirtstierspektrum dieser Art noch weitgehend unbekannt ist. Diese Zecke wird - im Gegensatz zum Holzbock - vermutlich nicht sehr häufig durch Vögel verschleppt.
- Wirte der Larven:
- Squamata: Verschiedene Eidechsen, ohne nähere Angaben. cit. Estrada-Peña A, Mihalca AD, Petney T (Eds.) [2017] S. 203.
- Wirte der Nymphen:
- Squamata: Verschiedene Eidechsen. cit. Estrada-Peña A, Mihalca AD, Petney T (Eds.) [2017] S. 203.
- Artiodactyla: Ovis orientalis aries Linnaeus, 1758 dt: Hausschaf.
- Wirte der ⇒ Adulten:
- Carnivora: Vulpes vulpes (Linnaeus, 1758) dt: Rotfuchs.
- Artiodactyla: Ovis orientalis aries Linnaeus, 1758 dt: Hausschaf.
Erregerfunktion: Nicht bekannt.
Vektorfunktion: Es lässt sich (noch) nicht viel dazu sagen, da nicht bekannt ist, ob der Mensch als Wirt überhaupt akzeptiert wird. DNS von Rickettsia helvetica Beati et al., 1993, einem unbestätigten Erreger einer Meningitis wurde aus Zecken dieser Art isoliert. Außerdem wurde DNS von Borrelia afzelii Canica et al., 1994, dem Erreger einer Hautborreliose und von Anaplasma phagocytophila (Foggie, 1949) Dumler et al., 2001, dem Erreger der Granulozytären Ehrlichiose in Zecken dieser Art in Deutschland nachgewiesen. cit. Hauck et al. [2019]. Nicht nachgewiesen, aber sehr wahrscheinlich ist die Vektorfunktion dieser Zecke im Falle von Borrelia lusitaniae Le Fleche et al., einem europäischen Erreger der Lyme-Borreliose, der eng mit Eidechsen assoziiert ist. Auffällig ist allerdings, dass niemals Material des FSME-Virus in dieser Zecke nachgewiesen werden konnte.
Ixodes laguri Olenev, 1929
Diese Zecken-Art könnte durch ein eiszeitliches Reliktvorkommen in Österreich heimisch sein. Der mittelalterliche, extensive Getreideanbau in Ostösterreich war für die vermuteten Nebenwirte, Ziesel und Feldhamster, eine gute Grundlage um ausgedehnte Populationen zu bilden, die das Fortexistieren dieser Zecken-Art ermöglichte. Einige meinen auch, dass dies die Zecken-Art ist, die bevorzugt an Hausmäusen und Hausratten parasitiert und damit ein ⇒ Zivilisationsfolger ist.
Synonyme:
I. redikorzevi lagurae Olenev, 1929;
I. redikorzevi laguri Olenev, 1930;
I. laguri laguri Kirschenblatt, 1938;
I. laguri armeniacus Pomerantzev et Kirschenblatt, 1946;
I. laguri colchicus Pomerantzev, 1946;
I. laguri Clifford et Anastos, 1960;
I. laguri slovacicus Černŷ, 1960;
I. laguri laguri Sénevet et Ripert, 1967;
I. armenicus Tumanyan, Ananyan et Chubkova, 1968.
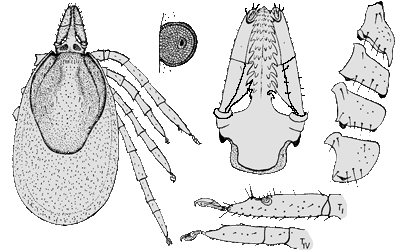 Weibchen: Der Körper des nüchternen Weibchens ist eher klein, 2,6 bis 3,6 mm lang und 1,2 bis 2,4 mm breit, länglich, nach vorne schmaler werdend, gelblichbraun. Vollgesogene Weibchen sind 9,8 mm lang und 5,8 mm breit. Das ⇒ Capitulum, die Beine und das Scutum sind hellbraun. Das Scutum ist länglich gestreckt, ca 1,3 mm lang, in der Mitte oder kurz davor am breitesten. Die Scapulae sind kräftig und spitz. Auf dem Scutum sitzt vorne und in der Mitte je eine Querreihe von Borstenhaaren (⇒ Setae). Das ⇒ Hypostom ist etwa 0,4 mm lang, dünn, nach vorne schmaler werdend. Es endet spitz. Es sind vierzehn Querreihen kräftiger und spitzer Zähne vorhanden. Die fünf distalen Reihen liegen schuppenförmig aufeinander. Von den anderen Zähnen sind die äußeren der Reihe spitz, ungefähr ab der siebenten Querreihe werden sie stumpf. Die Nahtlinie zwischen dem zweiten und dem dritten Glied der ⇒ Palpen ist deutlich zu sehen. Die Spirakularplatte ist rundlich, die Spirakularöffnung liegt zur Bauchseite hin verschoben. Außendorne befinden sich an allen Beincoxen. Die ⇒ Coxen des ersten Beinpaares trägt einen stark entwickelten Innendorn, die des zweiten Beinpaares ist innen immerhin noch deutlich zugespitzt. Am ersten Beinpaar sind die ⇒ Pulvilli deutlich größer als an den anderen Beinpaaren, sie erreichen die Spitzen der Krallen.
Weibchen: Der Körper des nüchternen Weibchens ist eher klein, 2,6 bis 3,6 mm lang und 1,2 bis 2,4 mm breit, länglich, nach vorne schmaler werdend, gelblichbraun. Vollgesogene Weibchen sind 9,8 mm lang und 5,8 mm breit. Das ⇒ Capitulum, die Beine und das Scutum sind hellbraun. Das Scutum ist länglich gestreckt, ca 1,3 mm lang, in der Mitte oder kurz davor am breitesten. Die Scapulae sind kräftig und spitz. Auf dem Scutum sitzt vorne und in der Mitte je eine Querreihe von Borstenhaaren (⇒ Setae). Das ⇒ Hypostom ist etwa 0,4 mm lang, dünn, nach vorne schmaler werdend. Es endet spitz. Es sind vierzehn Querreihen kräftiger und spitzer Zähne vorhanden. Die fünf distalen Reihen liegen schuppenförmig aufeinander. Von den anderen Zähnen sind die äußeren der Reihe spitz, ungefähr ab der siebenten Querreihe werden sie stumpf. Die Nahtlinie zwischen dem zweiten und dem dritten Glied der ⇒ Palpen ist deutlich zu sehen. Die Spirakularplatte ist rundlich, die Spirakularöffnung liegt zur Bauchseite hin verschoben. Außendorne befinden sich an allen Beincoxen. Die ⇒ Coxen des ersten Beinpaares trägt einen stark entwickelten Innendorn, die des zweiten Beinpaares ist innen immerhin noch deutlich zugespitzt. Am ersten Beinpaar sind die ⇒ Pulvilli deutlich größer als an den anderen Beinpaaren, sie erreichen die Spitzen der Krallen.
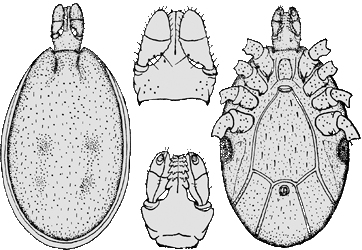 Männchen: Der Körper des Männchens ist braun, glänzend und länglich oval, hinter der Mitte am breitesten, etwa 1,9 bis 2,1 mm lang und 1,16 bis 1,24 mm breit. Die Scapulae sind lang und spitz. Die ⇒ Palpen sind kurz und breit. Das zweite Glied ist kürzer als das dritte. Die ⇒ Palpen sind an der Nahtlinie zwischen diesen am breitesten. Das Hypostom hat 6 bis 7 Querreihen von bis zu acht Zähnen. Die Zahnformel ist 2-2 bis 4-4. An der Basis steht ein einzelner, großer Zahn. Alle Beincoxen tragen Außendorne. Der Innendorn an den ⇒ Coxen des ersten Beinpaares ist kürzer als beim Weibchen, aber länger als der Außendorn. Auch die Coxen des zweiten und dritten Beinpaares tragen einen Innendorn.
Männchen: Der Körper des Männchens ist braun, glänzend und länglich oval, hinter der Mitte am breitesten, etwa 1,9 bis 2,1 mm lang und 1,16 bis 1,24 mm breit. Die Scapulae sind lang und spitz. Die ⇒ Palpen sind kurz und breit. Das zweite Glied ist kürzer als das dritte. Die ⇒ Palpen sind an der Nahtlinie zwischen diesen am breitesten. Das Hypostom hat 6 bis 7 Querreihen von bis zu acht Zähnen. Die Zahnformel ist 2-2 bis 4-4. An der Basis steht ein einzelner, großer Zahn. Alle Beincoxen tragen Außendorne. Der Innendorn an den ⇒ Coxen des ersten Beinpaares ist kürzer als beim Weibchen, aber länger als der Außendorn. Auch die Coxen des zweiten und dritten Beinpaares tragen einen Innendorn.
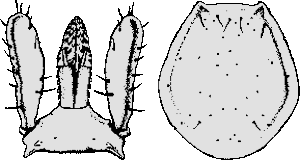 Nymphe: Die Nymphe ist 1,2 mm lang und in der Höhe der Spirakularplatten am breitesten. Die Spirakularplatten sind klein und rundlich. Die Spirakularöffnungen befinden sich in der Mitte. Die ⇒ Basis capituli trägt kleine ⇒ Cornua. An den Seitenflächen sind mittelgroße Erhebungen. Das Hypostom ist im unteren Drittel am breitesten. Es gibt 12 Querreihen an Hauptzähnen, neben denen sich jeweils ein Seitenzahn befindet. Die Nahtlinie auf den ⇒ Palpen ist nicht zu sehen. Die ⇒ Coxen des ersten und des zweiten Beinpaares tragen einen Außen- und Innendorn, die des dritten und des vierten nur einen Außendorn.
Nymphe: Die Nymphe ist 1,2 mm lang und in der Höhe der Spirakularplatten am breitesten. Die Spirakularplatten sind klein und rundlich. Die Spirakularöffnungen befinden sich in der Mitte. Die ⇒ Basis capituli trägt kleine ⇒ Cornua. An den Seitenflächen sind mittelgroße Erhebungen. Das Hypostom ist im unteren Drittel am breitesten. Es gibt 12 Querreihen an Hauptzähnen, neben denen sich jeweils ein Seitenzahn befindet. Die Nahtlinie auf den ⇒ Palpen ist nicht zu sehen. Die ⇒ Coxen des ersten und des zweiten Beinpaares tragen einen Außen- und Innendorn, die des dritten und des vierten nur einen Außendorn.
Larve: Der Körper ist 0,65 bis 0,7 mm lang und 0,5 bis 0,52 mm breit. Das Scutum ist schwach sechseckig, 0,25 bis 0,26 mm lang und 0,33 bis 0,34 mm breit. Die ⇒ Basis capituli trägt an ihren beiden Enden zwei winzige ⇒ Cornua. Das Hypostom hat 12 Querreihen an Hauptzähnen, neben denen sich je ein Nebenzahn befindet. Es verschmälert sich nach vorne und endet spitz. Die Außenseite der ⇒ Palpen ist hohl, die Innenfläche gewölbt, die Nahtlinie ist nicht zu sehen. An den ⇒ Coxen des ersten Beinpaares sitzt ein Innendorn. Andere Dornen sind nicht vorhanden zu sein. Die ⇒ Pulvilli erreichen in ihrer Längserstreckung die Spitzen der Krallen.
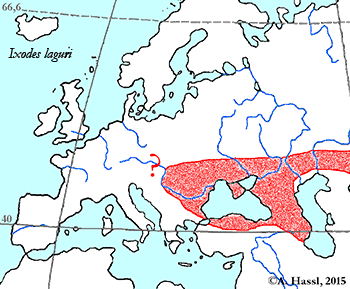 Verbreitung & Bionomie: Tiere der Art I. laguri wurden in West-Kasachstan, am unteren Don, im Westkaukasus, in Armenien, in der Türkei rund um Istanbul, Ankara und Izmir, an der türkischen Schwarzmeerküste, aber auch in der Slowakei und Ungarn (?) nachgewiesen, cit. Černŷ [1961], nicht aber in Österreich. Das Verbreitungsgebiet der Art strahlt aber wahrscheinlich bis nach Südosteuropa aus. Die östlichen, pannonischen Teile Österreichs könnten auch geeignete ⇒ Habitate bieten, sind doch Feldhamster als Folger des Getreideanbaus und Ziesel Charaktertiere dieser Region. Als vermutlich ausschließliche Wirtstiere werden Hamster, Ziesel und der in Österreich nicht heimische Steppenlemming Lagurus lagurus (Pallas, 1773) genannt. Im Pleistozän bewohnten große Mengen dieser Tiere die europäischen Kältesteppen von den Britischen Inseln bis nach Kasachstan. Sollte es sich dabei tatsächlich um den Hauptwirt handeln, dann wären Populationen dieser Zecke in Österreich schützenswerte Reliktpopulationen. Ein Autor nennt auch andere, frei-lebende Kleinsäuger als Wirte. Allerdings lebt diese Zecken-Art in den Wohnhöhlen der Wirte, es handelt sich also um eine typische ⇒ nidikole Art, weshalb nicht-in-Bauen-lebende Tiere als reguläre Wirte unwahrscheinlich erscheinen. Die Männchen saugen nicht. Die Begattung findet nicht auf dem Wirt, sondern im Detritus der Höhle statt. Bei der Aktivität dieser Art ist keine saisonale Periodizität feststellbar. Die meisten Larven tauchen im Oktober und November auf, nachdem die Weibchen im August ihre Eier gelegt haben. Experimentell erweisen sich als zum Überwintern günstige Lebensstadien entweder die Eier oder, noch besser, nüchterne und vollgesogene Larven. Die Weibchen scheinen nur nüchtern ohne eine allzu große Ausfallsrate Überwintern zu können. Die Entwicklungsdauer scheint unter den experimentellen Bedingungen nur zwei Jahre zu betragen. Im Freiland rechnet man aber mit vielen überwinternden Adulten und damit doch mit einer Dauer von drei Jahren. cit. Honzáková et al. [1980].
Verbreitung & Bionomie: Tiere der Art I. laguri wurden in West-Kasachstan, am unteren Don, im Westkaukasus, in Armenien, in der Türkei rund um Istanbul, Ankara und Izmir, an der türkischen Schwarzmeerküste, aber auch in der Slowakei und Ungarn (?) nachgewiesen, cit. Černŷ [1961], nicht aber in Österreich. Das Verbreitungsgebiet der Art strahlt aber wahrscheinlich bis nach Südosteuropa aus. Die östlichen, pannonischen Teile Österreichs könnten auch geeignete ⇒ Habitate bieten, sind doch Feldhamster als Folger des Getreideanbaus und Ziesel Charaktertiere dieser Region. Als vermutlich ausschließliche Wirtstiere werden Hamster, Ziesel und der in Österreich nicht heimische Steppenlemming Lagurus lagurus (Pallas, 1773) genannt. Im Pleistozän bewohnten große Mengen dieser Tiere die europäischen Kältesteppen von den Britischen Inseln bis nach Kasachstan. Sollte es sich dabei tatsächlich um den Hauptwirt handeln, dann wären Populationen dieser Zecke in Österreich schützenswerte Reliktpopulationen. Ein Autor nennt auch andere, frei-lebende Kleinsäuger als Wirte. Allerdings lebt diese Zecken-Art in den Wohnhöhlen der Wirte, es handelt sich also um eine typische ⇒ nidikole Art, weshalb nicht-in-Bauen-lebende Tiere als reguläre Wirte unwahrscheinlich erscheinen. Die Männchen saugen nicht. Die Begattung findet nicht auf dem Wirt, sondern im Detritus der Höhle statt. Bei der Aktivität dieser Art ist keine saisonale Periodizität feststellbar. Die meisten Larven tauchen im Oktober und November auf, nachdem die Weibchen im August ihre Eier gelegt haben. Experimentell erweisen sich als zum Überwintern günstige Lebensstadien entweder die Eier oder, noch besser, nüchterne und vollgesogene Larven. Die Weibchen scheinen nur nüchtern ohne eine allzu große Ausfallsrate Überwintern zu können. Die Entwicklungsdauer scheint unter den experimentellen Bedingungen nur zwei Jahre zu betragen. Im Freiland rechnet man aber mit vielen überwinternden Adulten und damit doch mit einer Dauer von drei Jahren. cit. Honzáková et al. [1980].
Wirte aller Stadien: Höhlenbewohnende Nagetiere der Steppe. Vielleicht auch Getreideschädlinge aus der Säugetierklasse, dann handelt es sich nicht nur um einen Folger des Getreideanbaus, sondern um einen ⇒ Zivilisationsfolger. Angeblich kann man diese Zecke auch am Menschen saugend (?) finden. cit. Bursali et al. [2010].
- Heimische Wirte:
- Rodentia: Spermophilus citellus (Linnaeus, 1766) dt: Europäisches Ziesel;
- Cricetus cricetus (Linnaeus, 1758) dt: Feldhamster;
- Arvicola terrestris (Linnaeus, 1758) dt: Ostschermaus;
- Microtus arvalis (Pallas, 1778) dt: Feldmaus;
- Chionomys nivalis Martins, 1842 dt: Schneemaus;
- Mus musculus Linnaeus, 1758 dt: Hausmaus;
- Rattus rattus (Linnaeus, 1758) dt: Hausratte.
Erreger- und Vektorfunktion: Nicht bekannt.
Ixodes (Pholeoixodes) lividus Koch, 1844
dt: Uferschwalbenzecke, en: Sand martin tick
Abb. VIII.5.43: Ixodes lividus ♀. © University of Bristol.
Die Tiere dieser Art zeigen auffallend häufig starke individuelle Unterschiede in der Morphologie. Die sicherste Art der Zuordnung einer Zecke zu dieser Art ist daher die ausgeprägte Monophagie.
Synonyme:
I. plumbeus Leach, 1815;
I. plumbeus plumbeus Leach, 1815;
I. obotriticus bavaricus Schulze et Schlottke, 1930;
I. plumbeus obotriticus Schulze et Schlottke, 1930;
I. lividus obotriticus Schulze, 1937;
I. lividus bavaricus Schulze, 1937;
I. hirundinicola Schulze, 1944;
I. canisuga obotriticus Buitendijk, 1945;
I. plumbeus obturatorius Babos, 1964;
I. lividus Sénevet et Ripert, 1967;
I. hexagonus inchoatus Neumann, 1901;
I. inchoatus Banks, 1907;
I. hexagonus inchoatus Neumann, 1911;
I. marii Olenev, 1934;
I. marxi Clifford et Anastos, 1960;
Pholeoixodes lividus Morel et Pérez, 1973.
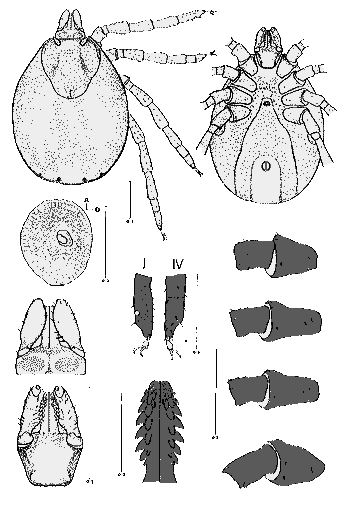 Weibchen: Das Scutum ist am Hinterende breit oval. Auf den Seitenfeldern verlaufen Längsfurchen. Das Scutum ist grob und spärlich punktiert. Die Scapulae sind spitz. Die ⇒ Basis capituli ist sechseckig. Die ⇒ Areae porosae sind groß und unregelmäßig geformt. Zwischen ihnen befindet sich eine längs verlaufende Mulde. Die ⇒ Palpen sind kurz, ihre Außenseite ist gerade, ihre Innenseite gewölbt. Das ⇒ Hypostom verjüngt sich nach vorne. Es trägt acht bis neun Seitenzähne. Seiten- und Innenzähne sind spitz. Die Spirakularplatten sind oval und in Querrichtung ausgezogen. Die ⇒ Genitalöffnung ist bogenförmig. Dornen finden sich auf die Beincoxen nicht. Die ⇒ Coxen des zweiten Beinpaares sind wesentlich breites als die des dritten Paares.
Weibchen: Das Scutum ist am Hinterende breit oval. Auf den Seitenfeldern verlaufen Längsfurchen. Das Scutum ist grob und spärlich punktiert. Die Scapulae sind spitz. Die ⇒ Basis capituli ist sechseckig. Die ⇒ Areae porosae sind groß und unregelmäßig geformt. Zwischen ihnen befindet sich eine längs verlaufende Mulde. Die ⇒ Palpen sind kurz, ihre Außenseite ist gerade, ihre Innenseite gewölbt. Das ⇒ Hypostom verjüngt sich nach vorne. Es trägt acht bis neun Seitenzähne. Seiten- und Innenzähne sind spitz. Die Spirakularplatten sind oval und in Querrichtung ausgezogen. Die ⇒ Genitalöffnung ist bogenförmig. Dornen finden sich auf die Beincoxen nicht. Die ⇒ Coxen des zweiten Beinpaares sind wesentlich breites als die des dritten Paares.
Männchen: Sie sehen im äußeren Erscheinungsbild angeblich fast genauso aus wie die Weibchen. Möglicherweise handelt es sich aber bei dieser Beobachtung um einen Fall von ⇒ Gynandromorphismus, Scheinzwittertum. Die Männchen sind nur schwach pigmentiert. Dies lässt darauf schließen, dass die Männchen entweder gar nicht oder nur kurz Blut saugen und die dunklen Bruthöhlen der Uferschwalben sehr selten oder nie verlassen.
Nymphe: Das Scutum ist länger als breit, am breitesten im vorderen Viertel, wo sich die Seitenfelder spitz verbreitern. Die ⇒ Basis capituli trägt an den beiden ⇒ posterioren Außenecken große, zahnartige ⇒ Cornua. Das Hypostom ist in der Mitte am breitesten und wird dann nach vorne schmaler. Es trägt sechs Seitenzähne. Die ⇒ Coxen tragen keine Dornen, der hintere Winkel der Coxen des ersten Beinpaares ist höchstens zahnartig spitz. Die Mitte der Coxen des dritten Beinpaares verjüngt sich.
Larve: Auch in diesem Stadium trägt die ⇒ Basis capituli gut entwickelte, spitze ⇒ Cornua. Das Hypostom ist kurz und massiv, mit einer stumpfen Spitze. Es hat fünf oder sechs Seitenzähne, neben jedem einen Innenzahn. An den ⇒ Coxen des ersten Beinpaares sitzt ein winziger Dorn, die anderen Coxen sind ohne Dornen.
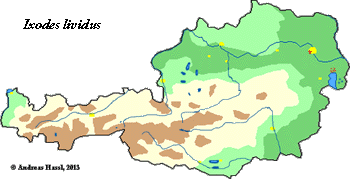
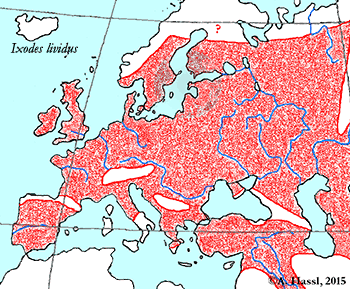 Verbreitung & Bionomie: Diese Art, die Uferschwalbenzecke, ist streng wirtsspezifisch, vermutlich auf Artniveau. Sie parasitiert ausschließlich an der Uferschwalbe. Ein Fund an Hirundo rustica Linnaeus, 1758, der Rauchschwalbe, scheint auf einem Zufall oder einer Fehlbestimmung zu beruhen. cit. Siuda et al. [2006]. Ein alternativer Wirt scheint nicht zu existieren. Da die Zecke ihrem Wirt nicht in das Winterquartier in Afrika folgt, ist ihre Verbreitung streng an die Brutareale der Uferschwalben gekoppelt. Allerdings wird von einigen Autoren das Vorkommen dieser Zecke in Europa auf südlich des 64. Breitengrades beschränkt, obwohl die Uferschwalbe stellenweise bis zum 72. Breitengrad brütet. Gleichzeitig werden Gebirgsregionen in das Verbreitungsgebiet der Uferschwalbenzecke aufgenommen, obgleich die Uferschwalbe nirgendwo in Europa in höher Gegenden als 750 m brütet.
Verbreitung & Bionomie: Diese Art, die Uferschwalbenzecke, ist streng wirtsspezifisch, vermutlich auf Artniveau. Sie parasitiert ausschließlich an der Uferschwalbe. Ein Fund an Hirundo rustica Linnaeus, 1758, der Rauchschwalbe, scheint auf einem Zufall oder einer Fehlbestimmung zu beruhen. cit. Siuda et al. [2006]. Ein alternativer Wirt scheint nicht zu existieren. Da die Zecke ihrem Wirt nicht in das Winterquartier in Afrika folgt, ist ihre Verbreitung streng an die Brutareale der Uferschwalben gekoppelt. Allerdings wird von einigen Autoren das Vorkommen dieser Zecke in Europa auf südlich des 64. Breitengrades beschränkt, obwohl die Uferschwalbe stellenweise bis zum 72. Breitengrad brütet. Gleichzeitig werden Gebirgsregionen in das Verbreitungsgebiet der Uferschwalbenzecke aufgenommen, obgleich die Uferschwalbe nirgendwo in Europa in höher Gegenden als 750 m brütet.
Diese Zecken-Art findet man in den Nestern der Uferschwalben, die von diesen in Sandhöhlen entlang der Böschungen von Flussufern sowie in Sand- und Kiesgruben kolonieweise angelegt werden. Diese Zecke hat vermutlich einen fixen Einjahres-Lebenszyklus. Die Larven überwintern in den leeren Höhlen im ehemaligen Nistmaterial. Wenn die Schwalben im April von der Überwinterung eintreffen, saugen die Larven an den erwachsenen Vögeln erstmalig Blut. Ende Juni oder Anfang Juli entwickeln sich die Nymphen, ungefähr zu dem Zeitpunkt, zu dem die Jungvögel schlüpfen. Die Nymphen saugen überwiegend an den Küken. Die adulten Zecken legen ihre Eier noch in demselben Jahr, der Schlupf der Larven erfolgt nach dem Verlassen der Bruthöhlen im Oktober. Bekannte Vorkommen dieser Zecken-Art sind in England, Irland, Frankreich, Belgien, Holland, Deutschland, Österreich, Dänemark, Norwegen, Schweden, Polen, der ehemaligen SSR, Lettland und Skandinavien. In SO-Finnland waren im Frühjahr und im Herbst in Uferschwalbenkolonien 15% der erwachsenen Vögel von Larven und Nymphen dieser Zecke befallen, Küken zu 20% von erwachsenen Weibchen parasitiert. Die Männchen leben hingegen frei in den Nestern. Einige Autoren vermuten, dass die durchschnittliche Lebensdauer dieser Zecke länger als ein Jahr beträgt. Dies erscheint allerdings nicht sehr wahrscheinlich, da dann zusätzlich zu den Larven die erwachsenen Tiere überwintern müssten und ihren eigenen Larven im Frühjahr Nahrungskonkurrent wären. Da die Bestände der Uferschwalbe sehr starken Schwankungen unterliegen, ist anzunehmen, dass auch dieser monophage ⇒ Ektoparasit starken Bestandsschwankungen unterliegt. I. lividus kommt in Österreich im Burgenland vor, cit. Sixl [1971b] und Sixl et al. [1971b] und auch in Wien, Hütteldorf (Belegexemplar im Naturhistorischen Museum Wien). Als einziger Wirt wurde in Zentraleuropa die Uferschwalbe festgestellt. In Österreich wurden im Mai Nymphen und im November Larven in den Nestern der Uferschwalben gefunden.
 Wirte aller Stadien: Wahrscheinlich ist der einzige Wirt die Uferschwalbe.
Wirte aller Stadien: Wahrscheinlich ist der einzige Wirt die Uferschwalbe.
- Heimische Wirte:
- Passeriformes: Riparia riparia (Linnaeus, 1758) dt: Uferschwalbe.
Vektorfunktion: I. lividus wird mit dem Virus der Russischen Frühling-Sommer-Enzephalitis (RSSE) in Verbindung gebracht.
Ixodes persulcatus Schulze, 1930
dt: Taigazecke
Abb. VIII.5.48: Ixodes persulcatus ♀ .
© CC BY-SA 3.0.
Die Taigazecke ist eine der am häufigsten experimentell studierten Schildzecken-Arten. Es ist eine der Schildzecken mit einem ausgeprägten Sexualdimorphismus, die Männchen sind sehr viel kleiner als die Weibchen. Sie gilt als teilornithophil und als ⇒ telotropisch. In Österreich wurde sie nur einmal 1969 in Tirol bei Mutters nachgewiesen. cit. Mahnert [1971]. Ihr - zumindest immer wiederkehrendes - Vorkommen kann aber als gesichert angenommen werden, da sie jedes Jahr mit dem herbstlichen Vogelzug verschleppt wird und als kältetolerante Zecke sicherlich die heimischen Winter überleben kann. Viele in Nord- und Osteuropa brütende Singvögel ziehen vor dem Winter nach West- und Mitteleuropa, dieses Zugstrategie ist in den letzten Jahren sogar im Zunehmen. Ich glaube, dass ein beträchtlicher Teil der Holzbock-Meldungen im Herbst auf Funde von Taigazecken beruhen. Diese Spezies ist nicht leicht vom Holzbock zu unterscheiden, Fundmeldungen werden daher mit dieser Begründung gelegentlich bestritten.
Eine interessante Überlegung ist, ob und wenn ja, warum der heimische Holzbock hier in Zentraleuropa konkurrenzstärker ist als die Taigazecke. Dies ist deswegen von Bedeutung, weil eine russische Studie von Popov et Yasyukevich [2014] zum Schluss kommt, dass sich das Verbreitungsgebiet dieser Zecken-Art im 21. Jahrhundert erheblich nach Norden ausdehnen wird, bei gleichzeitigem Rückzug aus Osteuropa. Es wird allerdings nicht dargelegt, ob diese Zecke den zukünftigen nordosteuropäischen Sommer schlecht vertragen wird, oder die Lebensräume sich im Zuge einer globalen Erwärmung verändern oder die Taigazecke schlicht vom konkurrenzstärkeren Holzbock verdrängt werden wird.
Synonyme:
I. ricinus miyazakiensis Kishida, 1930;
I. persulcatus diversipalpis Schulze, 1930;
I. persulcatus persulcatus Schulze, 1930;
I. persulcatus cornuatus Olenev, 1941;
I. persulcatus Clifford et Anastos, 1960;
I. maslovi Emel’yanova et Kozlovskaya, 1967;
I. sachalinensis Filippova, 1971.
I. maslovi und I. sachalinensis sind vermutlich nur aberrante Formen von I. persulcatus. Die Synonyme sind umstritten, Guglielmone et Nava [2014] geben nur I. persulcatus diversipalpis und I. persulcatus persulcatus als Synonyme an.
 Weibchen: Nüchterne Weibchen sind 3,0 bis 3,6 mm lang, vollgesogene bis 11 mm. Das Schild ist 1,6 mm lang, im vorderen Drittel ist es am breitesten. Die Scapulae sind schwach entwickelt, aber spitz. Das Schild ist gleichmäßig und deutlich punktiert und spärlich mit Borstenhaaren (⇒ Setae) besetzt. Die Längsfalten am Schild, die Scapularfalten, sind sehr prominent. Die ⇒ Cornua auf der ⇒ Basis capituli sind kaum wahrnehmbar oder fehlen gänzlich. Das ⇒ Hypostom ist etwa 0,63 mm lang. An den Seiten befinden sich je zwölf spitze Seitenzähne. Die anderen Zähne sind ebenfalls zugespitzt. Die ⇒ Palpen sind vor dem Ende des zweiten Gliedes am breitesten. Ihr äußerer Rand ist etwas nach innen gewölbt, der innere nach außen. Die Bedornung der Beincoxen ist sehr ähnlich der von I. ricinus. An der hinteren Seite der ⇒ Coxen befinden sich auffallend lange Borstenhaare (Setae). An den Tarsi des ersten Beinpaares befindet sich vor dem Haller`schen Organ je ein tiefer Einschnitt. Die Coxen des ersten Beinpaares tragen lange, auffällige Innendornen, an den Coxen des zweiten, dritten und vierten Beinpaares sind unauffällige äußere Dornen. Die ⇒ Genitalöffnung sitzt zwischen den Coxen des vierten Beinpaares, wie bei I. ricinus. Das entscheidende Unterscheidungsmerkmal ist allerdings die Form der ⇒ Genitalöffnung, diese ist bei dieser Art gerade oder wellig.
Weibchen: Nüchterne Weibchen sind 3,0 bis 3,6 mm lang, vollgesogene bis 11 mm. Das Schild ist 1,6 mm lang, im vorderen Drittel ist es am breitesten. Die Scapulae sind schwach entwickelt, aber spitz. Das Schild ist gleichmäßig und deutlich punktiert und spärlich mit Borstenhaaren (⇒ Setae) besetzt. Die Längsfalten am Schild, die Scapularfalten, sind sehr prominent. Die ⇒ Cornua auf der ⇒ Basis capituli sind kaum wahrnehmbar oder fehlen gänzlich. Das ⇒ Hypostom ist etwa 0,63 mm lang. An den Seiten befinden sich je zwölf spitze Seitenzähne. Die anderen Zähne sind ebenfalls zugespitzt. Die ⇒ Palpen sind vor dem Ende des zweiten Gliedes am breitesten. Ihr äußerer Rand ist etwas nach innen gewölbt, der innere nach außen. Die Bedornung der Beincoxen ist sehr ähnlich der von I. ricinus. An der hinteren Seite der ⇒ Coxen befinden sich auffallend lange Borstenhaare (Setae). An den Tarsi des ersten Beinpaares befindet sich vor dem Haller`schen Organ je ein tiefer Einschnitt. Die Coxen des ersten Beinpaares tragen lange, auffällige Innendornen, an den Coxen des zweiten, dritten und vierten Beinpaares sind unauffällige äußere Dornen. Die ⇒ Genitalöffnung sitzt zwischen den Coxen des vierten Beinpaares, wie bei I. ricinus. Das entscheidende Unterscheidungsmerkmal ist allerdings die Form der ⇒ Genitalöffnung, diese ist bei dieser Art gerade oder wellig.
 Männchen: Auffällig kleine Schildzecken mit einer Körperlänge zwischen 2,4 und 2,8 mm und ovalem Umriss. Das Schild ist deutlich und gleichmäßig punktiertem, grau bis dunkelbraun gefärbt. Die ⇒ Basis capituli erstreckt sich nach vorne bis etwa auf die Höhe der Palpenmitten. Deutlich ausgeprägte ⇒ Auriculae. Das Hypostoma sieht ungefähr so aus wie beim Männchen von I. ricinus. Die ⇒ Palpen sind klein, kurz und keulenförmig. Auf der Innenseite des zweiten Gliedes werden sie abrupt schmaler. Die Bedornung der Beincoxa ist sehr ähnlich der I. ricinus. Die ⇒ Coxen des ersten Beinpaares tragen lange, auffällige interne Dornen, an den Coxen des zweiten, dritten und vierten Beinpaares sind unauffällige äußere Dornen. An den Tarsi des ersten Beinpaares befindet sich je ein tiefer Einschnitt. Die ⇒ Pulvilli am ersten Beinpaar sind deutlich größer als die an den anderen Beinpaaren. Die Prägenitalplatte ist ungefähr zweimal so lang wie breit, die Medianplatte ist lang und schmal.
Männchen: Auffällig kleine Schildzecken mit einer Körperlänge zwischen 2,4 und 2,8 mm und ovalem Umriss. Das Schild ist deutlich und gleichmäßig punktiertem, grau bis dunkelbraun gefärbt. Die ⇒ Basis capituli erstreckt sich nach vorne bis etwa auf die Höhe der Palpenmitten. Deutlich ausgeprägte ⇒ Auriculae. Das Hypostoma sieht ungefähr so aus wie beim Männchen von I. ricinus. Die ⇒ Palpen sind klein, kurz und keulenförmig. Auf der Innenseite des zweiten Gliedes werden sie abrupt schmaler. Die Bedornung der Beincoxa ist sehr ähnlich der I. ricinus. Die ⇒ Coxen des ersten Beinpaares tragen lange, auffällige interne Dornen, an den Coxen des zweiten, dritten und vierten Beinpaares sind unauffällige äußere Dornen. An den Tarsi des ersten Beinpaares befindet sich je ein tiefer Einschnitt. Die ⇒ Pulvilli am ersten Beinpaar sind deutlich größer als die an den anderen Beinpaaren. Die Prägenitalplatte ist ungefähr zweimal so lang wie breit, die Medianplatte ist lang und schmal.
Nymphe: Das Scutum ist etwas länger als breit. Die Spirakularplatten sind rund. An den Beincoxen des ersten Beinpaares befindet sich ein deutlich ausgebildeter, an denen des zweiten Beinpaares ein weniger deutlich ausgebildeter Innendorn. Alle ⇒ Coxen tragen Außendornen. Die ⇒ Basis capituli hat zwei gut entwickelte ⇒ Cornua und an den Seitenflächen zwei deutlich erkennbare Erhebungen. Das Hypostom ist im unteren Drittel am breitesten. Darüber verjüngt es sich allmählich zu Spitze hin.
Larve: Die nüchterne Larve ist in der Mitte am breitesten. Das Schild hat fast keine Furchen. Die ⇒ Basis capituli mit großen Hörnen und deutlichen Erhebungen an den Seitenwänden. Das Hypostom ist in der Mitte am breitesten. Die Spitze ist abgerundet. Die Zähne sind in Doppelreihen angeordnet.
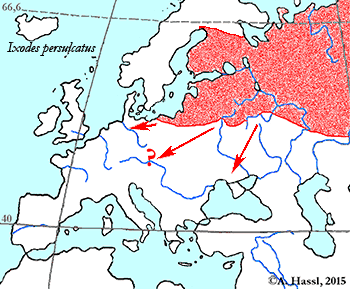 Verbreitung & Bionomie: Das Verbreitungsgebiet von I. persulcatus erstreckt sich vom Pazifischen Ozean über Sibirien bis nach Nordosteuropa, inklusive der Baltischen Staaten, Nordwestschweden und Polen. cit. Nowak-Chmura et Siuda [2012], Jaenson et Wilhelmsson [2019]. Diese Zecke ist ein Eurasisches Faunenelement. In einzelnen kleinen Gebieten kommt die Art auch in ⇒ Zentraleuropa vor, angeblich auch in Österreich, Deutschland, Polen und Ungarn. cit. Mahnert [1971]. Diese Angaben beruhen jedoch vermutlich auf den Funden von verschleppten Tieren und deren Nachkommen. Nach meiner Einschätzung können verschleppte Taigazecken allerdings immer wieder die Stammeltern von ⇒ allochthonen Populationen sein, die zumindest einige Jahre überdauern können - oder sich auch lokal dauerhaft etablieren. Wahrscheinlich sind diese fokalen Herde auf eine ehemalige Verschleppung durch Zugvögel zurückzuführen, die Taigazecke gilt als teilornithophil. Der Lebenszyklus dauert zwei bis fünf Jahre, abhängig vom Lokalklima. Die Adulttiere sind während des Frühjahrs und des Sommers aktiv, die subadulten Tiere während der ganzen warmen Jahreszeit. Alle Stadien sind allerdings zu Beginn der warmen Jahreszeit am aktivsten. I. persulcatus bevorzugt als Lebensraum Laub- und Mischwälder. Es handelt sich um eine ausgesprochen aggressive Art, die gerne auch den Menschen befällt.
Verbreitung & Bionomie: Das Verbreitungsgebiet von I. persulcatus erstreckt sich vom Pazifischen Ozean über Sibirien bis nach Nordosteuropa, inklusive der Baltischen Staaten, Nordwestschweden und Polen. cit. Nowak-Chmura et Siuda [2012], Jaenson et Wilhelmsson [2019]. Diese Zecke ist ein Eurasisches Faunenelement. In einzelnen kleinen Gebieten kommt die Art auch in ⇒ Zentraleuropa vor, angeblich auch in Österreich, Deutschland, Polen und Ungarn. cit. Mahnert [1971]. Diese Angaben beruhen jedoch vermutlich auf den Funden von verschleppten Tieren und deren Nachkommen. Nach meiner Einschätzung können verschleppte Taigazecken allerdings immer wieder die Stammeltern von ⇒ allochthonen Populationen sein, die zumindest einige Jahre überdauern können - oder sich auch lokal dauerhaft etablieren. Wahrscheinlich sind diese fokalen Herde auf eine ehemalige Verschleppung durch Zugvögel zurückzuführen, die Taigazecke gilt als teilornithophil. Der Lebenszyklus dauert zwei bis fünf Jahre, abhängig vom Lokalklima. Die Adulttiere sind während des Frühjahrs und des Sommers aktiv, die subadulten Tiere während der ganzen warmen Jahreszeit. Alle Stadien sind allerdings zu Beginn der warmen Jahreszeit am aktivsten. I. persulcatus bevorzugt als Lebensraum Laub- und Mischwälder. Es handelt sich um eine ausgesprochen aggressive Art, die gerne auch den Menschen befällt.
Wirte aller Stadien: I. persulcatus ist hochgradig ⇒ euryxen, es handelt sich aber um eine partiell ⇒ ornithophile Art. Als Wirte dienen den Adulttiere zahlreiche große und mittelgroße Säugetiere, die Larven und Nymphen findet man an kleinen und mittelgroßen Säugetieren und auch an Landvögeln. Es wird behauptet, dass diese Zecke an Individuen von über 300 Landsäugetier-Arten und von über 150 Vogel-Arten parasitiert, alleine die Literaturangaben dazu sind schwierig zu verifizieren. Zweifelsfrei steht fest, dass diese Zecke wenig wählerisch während ihres Wirtssuchverhaltens ist, ob sie aber auch jedes Blut verdauen kann, wurde nie nachgeprüft. Es handelt sich vermutlich um die in Europa im höchsten Grade ⇒ telotropische Art, deren einzelne Stadien von Tieren mit unterschiedlichstem Migrationsverhalten verschleppt werden können. Unbekannt ist aber, ob eine Blutmahlzeit am Transportwirt auch zur nächsten Häutung oder Ei-Ablage führt oder die Zecke nur ein Tier zur Ausbreitung im Raum nutzt, ohne es zu stechen.
- Heimische Wirte:
- Rodentia: Dryomys nitedula (Pallas, 1778) dt: Baumschläfer.
Erregerfunktion: Nicht bekannt.
Vektorfunktion: I. persulcatus fungiert als Hauptvektor für das Sibirische (TBEV-Sib) und das Fernöstliche (TBEV-FE) von Zecken übertragene Enzephalitis-Virus. Aus dieser Spezies wurden zwei weitere humanpathogene Viren isoliert, das Powassan Virus im Fernen Osten Russlands und das Kemerovo Virus, ein Meningitis-Erreger, in Europa. Hierzulande wird diese Spezies auch als Vektor für das Frühsommer-Meningoenzephalitisvirus (FSME) genannt, zudem soll sie das OHF-Virus (Omsker Hämorrhagisches Fieber-Virus) übertragen können. Diese Spezies beherbergt außerdem die Erreger der Lyme-Borreliose, Borrelia burgdorferi s.l. Johnson et al., 1984 emend. Baranton et al., 1992, Borrelia garinii Baranton et al., 1992, Borrelia valaisiana Wang et al. 1997 und Borrelia afzelii Canica et al., 1994, Borrelia miyamotoi Fukunaga et al., 1995, der Erreger eines Rückfallfiebers, zudem einen Babesioseerreger, Babesia microti Franca, 1912 = heute: Theileria microti, den Erreger der Humanen Monozytären Ehrlichiose, Ehrlichia muris Wen et al., 1995, Rickettsia helvetica Beati et al., 1993 und den der Granulozytäre Ehrlichiose, Anaplasma phagocytophilum (Foggie, 1949) Dumler et al., 2001.
Ixodes ricinus (Linnaeus, 1785)
dt: Gemeiner Holzbock, Waldzecke; en: sheep tick
Abb. VIII.5.52: Ixodes ricinus ♀. © unbekannt.
Der Gemeine Holzbock, Ixodes ricinus, ist die in Europa bekannteste und die am meisten gefürchtet Zecke, vielleicht sogar der berüchtigtste Arthropode überhaupt. Unzählige wissenschaftliche und pseudowissenschaftliche Studien wurden über diese Zecke und ihre Auswirkungen auf die menschliche Gesundheit und auf die Ökonomie verfasst. Dabei ist dieses Tier keineswegs die einzige Zecken-Art Europas, die den Menschen gerne als Wirt akzeptiert und als Vektor fungiert. Trotz - oder vielleicht wegen - der vielen Studien ist das fundamentalste biologische Problem, das des Wesens, ungeklärt: Mit größter Wahrscheinlich keit handelt es sich bei der Art I. ricinus um einen Artenkomplex, der noch dazu ⇒ paraphyletisch sein könnte, dh von mehr als einer Ursprungsart abstammt. cit. Xu et al. [2003]. Falls diese These zutrifft, ist der ganze Haufen an „gesichertem” Wissen um diese Art Makulatur. Unbestritten ist nur, dass Tiere dieser Art den Nord- und Zentraleuropäischen Lebensraum erst nach dem Abklingen der letzten Vereisung besiedelt haben können. cit. Dunlop et al. [2016]. Der Holzbock führt als ⇒ Epitheton in seinem wissenschaftlichen Namen das Wort „ricinus”. Dieses Wort wird in klassischen antiken Texten als Bezeichnung für ein „Ungeziefer an Schaf, Hund und Rind” verwendet und kann aus dem Lateinischen mit „Zecke” übersetzt werden. Der Wunderbaum, Ricinus communis L., wurde von Linné deshalb so benannt, weil sein Samen eine auffällige Ähnlichkeit mit einem Schildzecken-Weibchen im vollgesogenen Zustand hat - nicht umgekehrt, wie häufig behauptet.
Synonyme:
Ricinus caninus Ray, 1710; REM: Mir ist nicht bekannt, weshalb dieser Name nicht verwendet wird oder wurde.
Acarus reduvius Linnaeus, 1758; nach anderen Autoren: 1746 - dieses ⇒ Epitheton hätte dann allerdings Priorität.
Acarus ricinus Linnaeus, 1758;
Acarus sanguisugus Linnaeus, 1758;
Acarus collurionis Scopoli, 1763;
Acarus lipsiensis Fabricius, 1775;
Acarus ricinoides De Geer, 1778;
Acarus hirudo Fabricius, 1781;
Acarus holsatus Fabricius, 1787;
Acarus ricinoides De Geer, 1787
Acarus putorii Razoumowski, 1789;
Acarus rufipes Gmelin, 1790;
Ricinus caninis Valmont de Bomare, 1791;
Acarus vulgaris Fabricius, 1794;
Acarus caraborum Fabricius, 1794;
Acarus tristriatus Panzer, 1798;
Acarus fuscus Vallot, 1801;
Acarus ambulantium Gmelin, 1802;
Cynorhaestes ricinus Hermann, 1804;
I. reduvius Latreille, 1804;
I. sanguisugus Fabricius, 1805;
I. vulgaris Fabricius, 1805;
I. holsatus Fabricius, 1805;
I. lipsiensis Fabricius, 1805;
I. megathyreus Leach, 1815;
Cynorhaestes megathyreus Risso, 1826;
Cynorhaestes hermanni Risso, 1826;
I. bipunctatus Risso, 1826;
Crotonus ricinus Duméril, 1829;
I. trabeatus Audouin, 1832;
I. marginalis Hahn, 1835;
I. marginatus Burmeister, 1837
I. sciuri Koch, 1844;
I. fuscus Koch, 1844;
Amblyomma sanguisugum Koch, 1844;
I. tristriatus Koch, 1844;
I. sulcatus Koch, 1844;
I. rufus Koch, 1844;
I. lacertae Koch, 1844;
Ricinus lacertarum Contarini, 1847;
I. reticulatus Koch, 1856;
I. pustularum Mégnin, 1866;
I. fouisseur Mégnin, 1867;
I. vicinus Verrill, 1870;
I. fodiens Murray, 1877;
Pseudixodes holsatus Haller, 1882;
I. obscurus Neumann, 1899;
I. ovatus Neumann, 1899;
Euixodes ricinus Bonnet, 1908;
Euixodes reduvius Stephens et Christophers, 1908;
I. nigricans Neumann, 1908 und/oder 1911;
Rhipicephalus ricinus Marchoux et Couvy, 1912;
Boophilus ricinus Idoyaga, 1928;
Acarus ricinoides Oudemans, 1929;
I. areolaris Olenev, 1936
I. oncorhyncha Schulze, 1939
I. ricinus oncorhyncha Schulze, 1939;
Dermacentor ricinus Winer et Strakosch, 1941.
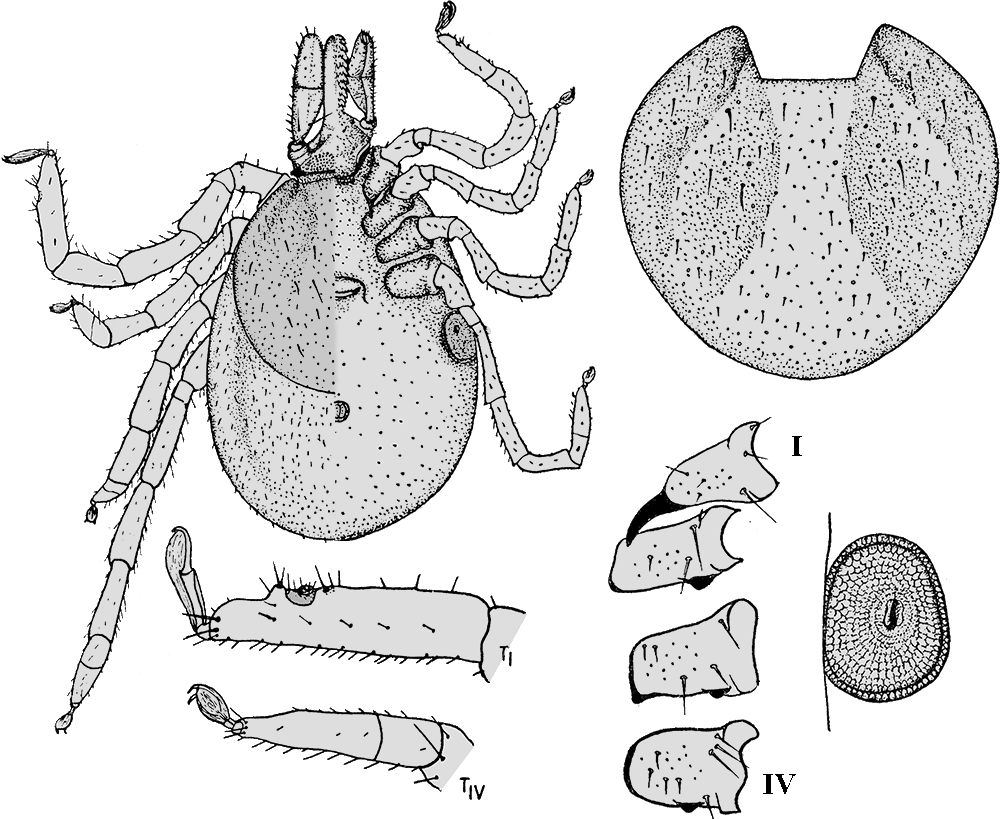 Weibchen: Nüchterne Weibchen sind in Rumänien durchschnittlich 6,8 mm lang, nach anderen Angaben nur 3,5 bis 4,5 mm, und 3,2 bis 3,8 mm breit. Sie haben einen gelbbraunen Körper mit dunkelbraunen Beinen, ⇒ Capitulum und Scutum. Vollgesogen färbt sich ihr Körper auf hell graubraun um, und sie sind dann durchschnittlich 11,4 bis 14 mm (Rumänien) lang und 6,6 bzw 9,6 mm breit. cit. Ionita et al. [2008]. Ihr Körper ist also bis zum Vierfachen dehnbar. Das Weibchen kann etwa das 100- bis 200-fache seines eigenen Gewichts an Blut aufnehmen, womit sich sein Volumen um etwa das 120-fache vergrößert.
Weibchen: Nüchterne Weibchen sind in Rumänien durchschnittlich 6,8 mm lang, nach anderen Angaben nur 3,5 bis 4,5 mm, und 3,2 bis 3,8 mm breit. Sie haben einen gelbbraunen Körper mit dunkelbraunen Beinen, ⇒ Capitulum und Scutum. Vollgesogen färbt sich ihr Körper auf hell graubraun um, und sie sind dann durchschnittlich 11,4 bis 14 mm (Rumänien) lang und 6,6 bzw 9,6 mm breit. cit. Ionita et al. [2008]. Ihr Körper ist also bis zum Vierfachen dehnbar. Das Weibchen kann etwa das 100- bis 200-fache seines eigenen Gewichts an Blut aufnehmen, womit sich sein Volumen um etwa das 120-fache vergrößert.
Das Scutum ist sehr kurz, rundlich bis oval, ⇒ posterior abgerundet und 0,78 bis 2,37 mm lang. Die Scapulae sind deutlich ausgeprägt. Es ist im vorderen Drittel am breitesten, mehr oder weniger gleichmäßig punktiert und mit verstreuten, feinen Borstenhaaren (⇒ Setae) bedeckt. Das ⇒ Capitulum ist 760 bis 880 μm lang, in Rumänien 960 - 1350 μm lang, die ⇒ Basis capituli ist pentagonal. Die ⇒ Areae porosae haben einen dreieckigen Umriss. Vier posthypostomale Setae sind in einer ⇒ konkaven ⇒ anterioren Linie angeordnet. Das ⇒ Hypostom ist 0,5 bis 0,57 mm lang und endet stumpf, nicht spitz. Es ist vorne am breitesten und verschmälert sich zum Körper hin leicht. Es trägt acht Querreihen von Zähnen. Die Zahnformel lautet distal 4-4; mittig 3-3 und proximal 2-2. Die beiden äußersten Reihen bestehen aus spitzen, nach unten gekrümmten Zähnen, die inneren Reihen existieren nur an der Spitze des Hypostoms und bestehen aus stumpfen Zähnchen. Die ⇒ Palpen sind langgestreckt, 485 bis 680 μm lang und 180 bis 255 μm breit. Das zweite Palpenglied ist länger als das dritte. Die Außenseiten sind gerade, die Innenseiten leicht gewölbt.
Die Spirakularplatten sind rundlich mit einem Durchmesser von etwa 0,3 mm. Die Spirakularöffnung liegt fast zentral in der Spirakularplatte. Die Beine sind dünn, mit einem langen Tarsus versehen. Alle Beincoxen tragen Außendornen. Die Beincoxen des ersten Beinpaares tragen außerdem je einen gut entwickelten Innendorn.
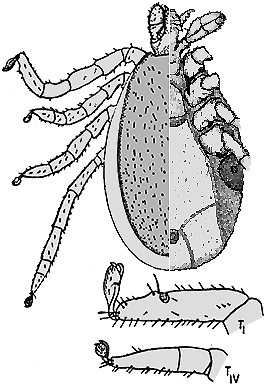
 Männchen: Die Männchen sind kleiner als das Weibchen, 2,5 mm bis 5,8 mm lang und 1,45 bis 2,86 mm breit. Das Scutum ist 1,96 bis 2,42 mm lang und 1,12 bis 1,3 mm breit, grauschwarz und spärlich mit helleren Borstenhaaren (Setae) bedeckt. Das ⇒ Capitulum, die Beine und die Bauchplatten sind im Leben dunkelbraun. Das ⇒ Capitulum ist kürzer als das der Weibchen, es ist 0,36 bis 0,46 mm lang. Die ⇒ Basis capituli ist ebenfalls pentagonal im Umriss, am Ursprungspunkt der ⇒ Palpen ist sie am breitesten. Die Basis capituli hat keine ⇒ Cornua. Die Länge der ⇒ Palpen beträgt zwischen 0,375 und 0,48 mm. Das Hypostom ist etwa 0,25 mm lang. Seine Spitze ist stumpf und zentral auffallend eingedellt. Am Hypostom befinden sich fünf, nach anderen Angaben sechs bis acht Reihen von Zähnen. Die Größe der Außenzähne nimmt zum Körper hin zu. Die anderen Zähne sind zu zackigen, nach hinten gerichteten Kämmen verbunden, die an den Seitenzähnen anfangen.
Männchen: Die Männchen sind kleiner als das Weibchen, 2,5 mm bis 5,8 mm lang und 1,45 bis 2,86 mm breit. Das Scutum ist 1,96 bis 2,42 mm lang und 1,12 bis 1,3 mm breit, grauschwarz und spärlich mit helleren Borstenhaaren (Setae) bedeckt. Das ⇒ Capitulum, die Beine und die Bauchplatten sind im Leben dunkelbraun. Das ⇒ Capitulum ist kürzer als das der Weibchen, es ist 0,36 bis 0,46 mm lang. Die ⇒ Basis capituli ist ebenfalls pentagonal im Umriss, am Ursprungspunkt der ⇒ Palpen ist sie am breitesten. Die Basis capituli hat keine ⇒ Cornua. Die Länge der ⇒ Palpen beträgt zwischen 0,375 und 0,48 mm. Das Hypostom ist etwa 0,25 mm lang. Seine Spitze ist stumpf und zentral auffallend eingedellt. Am Hypostom befinden sich fünf, nach anderen Angaben sechs bis acht Reihen von Zähnen. Die Größe der Außenzähne nimmt zum Körper hin zu. Die anderen Zähne sind zu zackigen, nach hinten gerichteten Kämmen verbunden, die an den Seitenzähnen anfangen.
Auf der ⇒ Ventralseite sitzen drei unpaare Platten, die Prägenitale, die Genitoanale und die Analplatte, sowie zwei Paare an paarigen Platten, die Adanalen und die Epimeralen. Alle Beincoxen tragen Außendornen. Die Beincoxen des ersten Beinpaares tragen außerdem je einen gut entwickelten Innendorn.
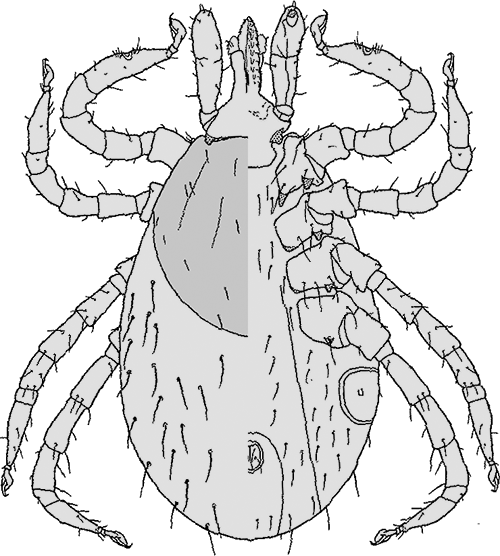
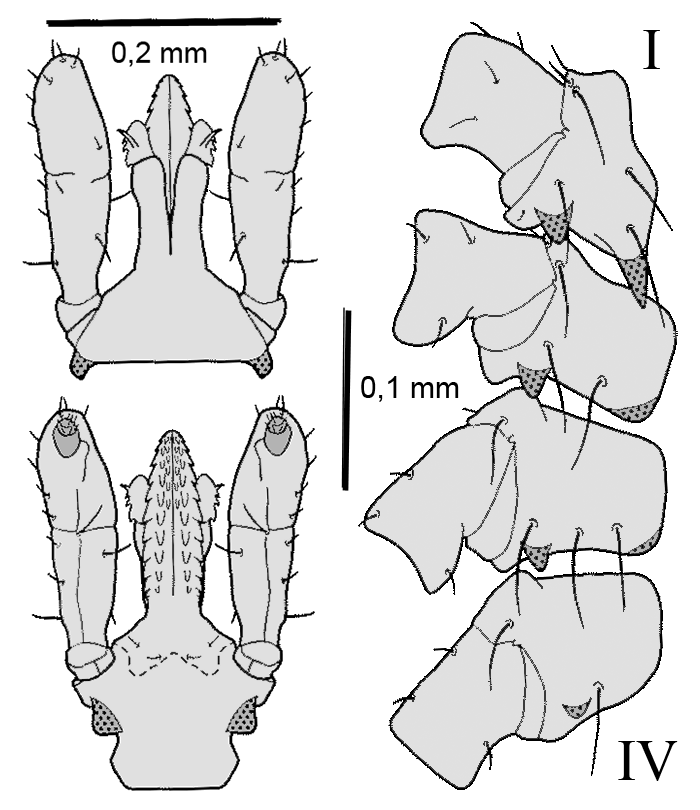 Nymphe: Nüchterne Nymphen sind gut 1 mm lang. Ihr Körper ist länglich oval, hellbraun, vollgesogen hell graubraun. Schild, Beine und ⇒ Capitulum sind dunkelbraun. Die größte Breite hat der Körper kurz vor den Spirakularplatten. Die ⇒ Palpen entspringen auffallend weit seitlich am ⇒ Capitulum. Sowohl ihr äußerer wie ihr innerer Rand verlaufen gerade. Das etwa 0,17 mm lange Hypostom ist ungefähr in der Mitte am breitesten. Es endet spitz. Es sind an die zwölf Querreihen von Zähnen vorhanden. Die Zahnformel lautet 3-3, weiter körperwärts 2-2. Ventralseitig ist zwischen den Zähnen ⇒ median eine deutlich ausgeprägte Rinne. Alle Beincoxen tragen Außendornen. Die Beincoxen des ersten Beinpaares tragen außerdem je einen gut entwickelten Innendorn. 2 bis 4 % der Nymphen in Deutschland sind parasitiert von der Erzwespe Ixodiphagus hookeri (Howard, 1908). cit. Collatz et al. [2011].
Nymphe: Nüchterne Nymphen sind gut 1 mm lang. Ihr Körper ist länglich oval, hellbraun, vollgesogen hell graubraun. Schild, Beine und ⇒ Capitulum sind dunkelbraun. Die größte Breite hat der Körper kurz vor den Spirakularplatten. Die ⇒ Palpen entspringen auffallend weit seitlich am ⇒ Capitulum. Sowohl ihr äußerer wie ihr innerer Rand verlaufen gerade. Das etwa 0,17 mm lange Hypostom ist ungefähr in der Mitte am breitesten. Es endet spitz. Es sind an die zwölf Querreihen von Zähnen vorhanden. Die Zahnformel lautet 3-3, weiter körperwärts 2-2. Ventralseitig ist zwischen den Zähnen ⇒ median eine deutlich ausgeprägte Rinne. Alle Beincoxen tragen Außendornen. Die Beincoxen des ersten Beinpaares tragen außerdem je einen gut entwickelten Innendorn. 2 bis 4 % der Nymphen in Deutschland sind parasitiert von der Erzwespe Ixodiphagus hookeri (Howard, 1908). cit. Collatz et al. [2011].
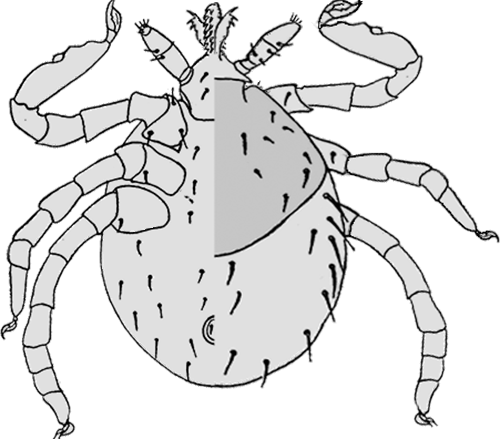
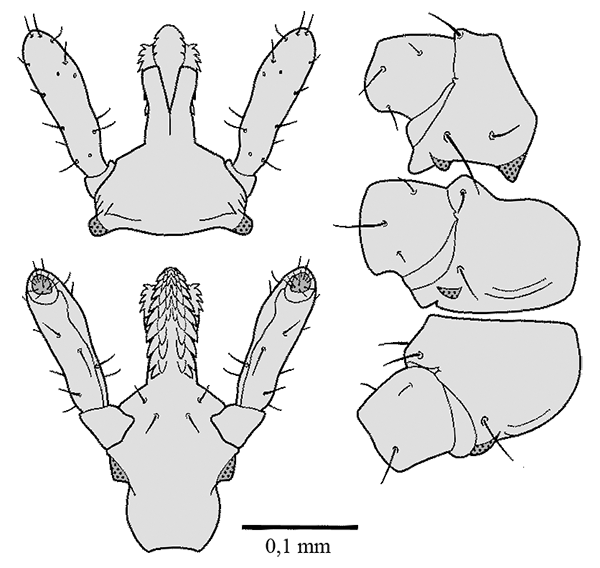 Larve: Die Larven sind 0,5 bis 0,6 mm lang und 0,35 bis 0,4 mm breit. Am breitesten sind sie am hinteren Ende des mehr oder weniger fünfeckigen Scutums. Das Scutum misst 0,29 mal 0,33 mm. Auf dem Scutum stehen sechs Längsreihen aus je drei Borstenhaaren (Setae). Die Scapulae sind stumpf. Das ⇒ Capitulum ist 0,19 bis 0,21 mm lang. Die ⇒ Palpen sind 0,13 mm lang, keulenförmig und stehen weit außen am Rand der ⇒ Basis capituli. Die Nahtlinie zwischen dem zweiten und dem dritten Glied ist nicht zu erkennen, in anderen Abbildungen ist sie jedoch deutlich zu erkennen. Die äußeren Seiten der ⇒ Palpen sind mehr oder weniger gerade, die innere gewölbt. Das Hypostom ist etwa 0,13 mm lang, langgestreckt und mehr oder weniger gleichmäßig dick, mit neun Querreihen zu je 2-2 Zähnen. Alle Beincoxen tragen Außendornen. Die Beincoxen des ersten Beinpaares tragen außerdem je einen gut entwickelten Innendorn. Im Durchschnitt wird jede Gelbhals- oder Rötelmaus im Frühjahr von 20 bis 50 Larven befallen, wobei die männlichen Mäuse aufgrund ihres größeren Aktionsraums stärker befallen sind.
Larve: Die Larven sind 0,5 bis 0,6 mm lang und 0,35 bis 0,4 mm breit. Am breitesten sind sie am hinteren Ende des mehr oder weniger fünfeckigen Scutums. Das Scutum misst 0,29 mal 0,33 mm. Auf dem Scutum stehen sechs Längsreihen aus je drei Borstenhaaren (Setae). Die Scapulae sind stumpf. Das ⇒ Capitulum ist 0,19 bis 0,21 mm lang. Die ⇒ Palpen sind 0,13 mm lang, keulenförmig und stehen weit außen am Rand der ⇒ Basis capituli. Die Nahtlinie zwischen dem zweiten und dem dritten Glied ist nicht zu erkennen, in anderen Abbildungen ist sie jedoch deutlich zu erkennen. Die äußeren Seiten der ⇒ Palpen sind mehr oder weniger gerade, die innere gewölbt. Das Hypostom ist etwa 0,13 mm lang, langgestreckt und mehr oder weniger gleichmäßig dick, mit neun Querreihen zu je 2-2 Zähnen. Alle Beincoxen tragen Außendornen. Die Beincoxen des ersten Beinpaares tragen außerdem je einen gut entwickelten Innendorn. Im Durchschnitt wird jede Gelbhals- oder Rötelmaus im Frühjahr von 20 bis 50 Larven befallen, wobei die männlichen Mäuse aufgrund ihres größeren Aktionsraums stärker befallen sind.
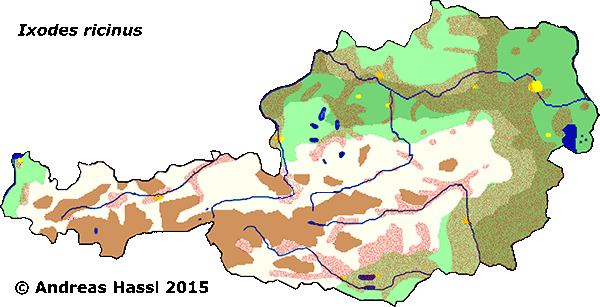
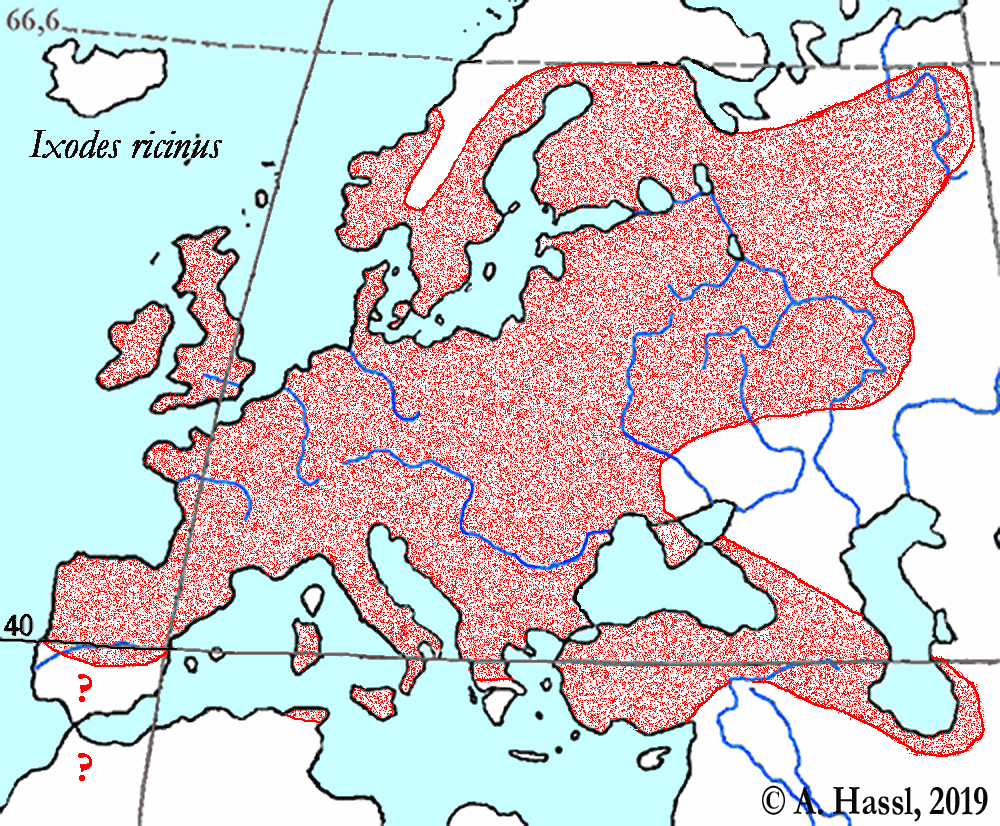 Verbreitung: I. ricinus gilt als die europäische Zecken-Art. Sie bevorzugt die gemäßigte Klimazone Europas. Alle bisher gefundenen Exemplaren mit wenigen Ausnahmen stammen von Orten nördlich des 40. Breitengrades. Das Hauptverbreitungsgebiet liegt zwischen dem 50. und 60. Breitengrad. Insbesondere in Mitteleuropa und in den noch atlantisch beeinflussten Gebiet Weiß- und Westrusslands scheint sie günstige Bedingungen vorzufinden. Die kürzlich erfolgte Abgrenzung des Holzbocks von I. inopinatus, der xerophilen Ixodes-Art Südspaniens und des Nordmaghrebs, hat die Diskussion über die Verbreitung und die Lebensraumansprüche des Holzbocks erkennbar beruhigt. cit. Estrada-Peña et al. [2014]. Funde von I. ricinus in Nordafrika wurden immer in Frage gestellt, jedoch erscheint das Auftreten dieser Art in Tunesien an einer Zugvogelroute eine logische Konsequenz der teilweisen Ornithophilie zu sein. cit. Younsi et al. [2019]. Der Holzbock ist in ganz Österreich verbreitet; die Fundorte erstrecken sich von der Tiefebene um den Neusiedler See bis in die alpine Region. Der bisher höchstgelegener Fundort liegt am Timmelsjoch, auf 2500 m, auf einer Schneemaus. Es besteht allerdings der Verdacht, dass I. ricinus in diesen Höhen durch die Wanderungen von Schafherden verschleppt wird. Häufig ist diese Art nur in Lagen unter 700 Höhenmetern, in höheren Lagen dauert der Lebenszyklus zu lange, dh mehr als 5 Jahre. Der Holzbock ist die Zecke der Randzonen von Laub- und Mischwäldern in feuchten Tälern und Talsenken Europas. Dies ist allerdings ein in ganz Europa zusehends schwindender Lebensraum. Ob die sich an seiner statt ausdehnenden Park-, Sport- und Freizeitareale einen geeigneten Ersatzlebensraum bieten können, ist zweifelhaft. Eine weitgehende Verdrängung des Holzbocks in Europa durch die Igelzecke, I. hexagonus, erscheint möglich.
Verbreitung: I. ricinus gilt als die europäische Zecken-Art. Sie bevorzugt die gemäßigte Klimazone Europas. Alle bisher gefundenen Exemplaren mit wenigen Ausnahmen stammen von Orten nördlich des 40. Breitengrades. Das Hauptverbreitungsgebiet liegt zwischen dem 50. und 60. Breitengrad. Insbesondere in Mitteleuropa und in den noch atlantisch beeinflussten Gebiet Weiß- und Westrusslands scheint sie günstige Bedingungen vorzufinden. Die kürzlich erfolgte Abgrenzung des Holzbocks von I. inopinatus, der xerophilen Ixodes-Art Südspaniens und des Nordmaghrebs, hat die Diskussion über die Verbreitung und die Lebensraumansprüche des Holzbocks erkennbar beruhigt. cit. Estrada-Peña et al. [2014]. Funde von I. ricinus in Nordafrika wurden immer in Frage gestellt, jedoch erscheint das Auftreten dieser Art in Tunesien an einer Zugvogelroute eine logische Konsequenz der teilweisen Ornithophilie zu sein. cit. Younsi et al. [2019]. Der Holzbock ist in ganz Österreich verbreitet; die Fundorte erstrecken sich von der Tiefebene um den Neusiedler See bis in die alpine Region. Der bisher höchstgelegener Fundort liegt am Timmelsjoch, auf 2500 m, auf einer Schneemaus. Es besteht allerdings der Verdacht, dass I. ricinus in diesen Höhen durch die Wanderungen von Schafherden verschleppt wird. Häufig ist diese Art nur in Lagen unter 700 Höhenmetern, in höheren Lagen dauert der Lebenszyklus zu lange, dh mehr als 5 Jahre. Der Holzbock ist die Zecke der Randzonen von Laub- und Mischwäldern in feuchten Tälern und Talsenken Europas. Dies ist allerdings ein in ganz Europa zusehends schwindender Lebensraum. Ob die sich an seiner statt ausdehnenden Park-, Sport- und Freizeitareale einen geeigneten Ersatzlebensraum bieten können, ist zweifelhaft. Eine weitgehende Verdrängung des Holzbocks in Europa durch die Igelzecke, I. hexagonus, erscheint möglich.
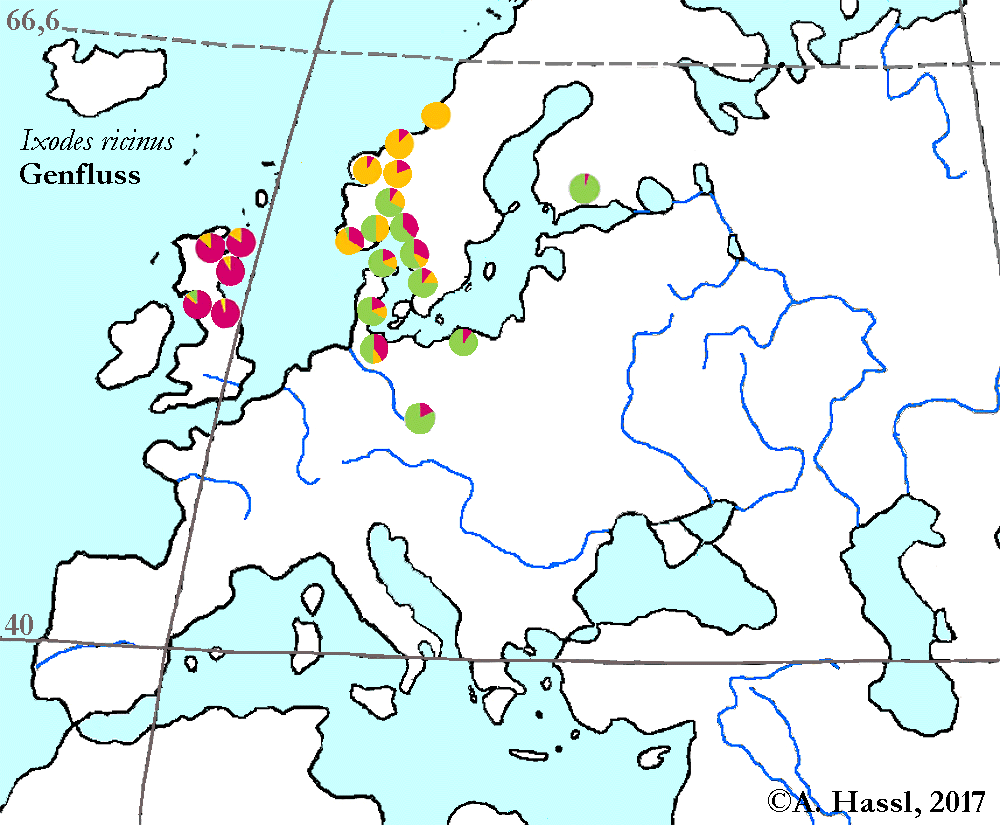
Abb. VIII.5.60: Genetisch differente Populationen von I. ricinus in Nordeuropa. Gelb: Westnorwegische ⇒ Klade, weinrot: GB-Klade, grün: EU-Klade. Farbige Segmente geben den Anteil an Genmaterial in der lokalen Population wieder.
umgezeichnet cit. Røed et al. [2016].
Ausbreitungsgeschichte: Das Gebiet, in dem die Art I. ricinus entstanden ist, ist unbekannt, ebenso der Zeitpunkt der Entwicklung. Man geht allerdings davon aus, dass diese Art oder ihre Vorläuferart bereits vor der letzten Kaltzeit, die vor etwa 115 000 bis 110 000 Jahren begann, in Europa heimisch war. Sie überdauerte die Eiszeit vermutlich mit ihren Wirtstieren in einem oder in beiden klassischen europäischen Refugialräumen, der Iberischen Halbinsel und dem Balkan- und Schwarzmeerraum. Es gibt schwache Hinweise darauf, dass in Europa derzeit zwei Populationen existieren, die aus der ⇒ postglazialen Neubesiedlung resultieren. Diese werden (vorläufig) "clade A" und "clade B" genannt. Klade A besiedelte England und Schottland vor der Bildung des Ärmelkanals vor etwa 8 500 Jahren. Klade B erreichte erst danach Nordfrankreich und schaffte es nicht mehr, England zu besiedeln. Daraus wird konsequenterweise abgeleitet, dass Säugetiere und nicht Vögel den Holzbock in der Fläche verteilen. Ein weiteres Argument für diese Ansicht ist die Bildung einer genetisch deutlich differenzierten Zecken-Population in West-Norwegen. Diese Population entstand durch die Trennwirkung des Südnorwegischen Bergrückens, der für kleine Säugetiere schwierig zu überwinden ist. Effektive Verschlepper für Holzböcke sind hingegen die Huftiere, die Norwegen um 7 000 vChr besiedelten. Die höchste Vermehrungsrate und zugleich die rascheste Ausbreitung erfuhr der Holzbock zu den Zeiten, als in Europa die durchgehende Bodenbedeckung durch dichte Urwälder aufgebrochen wurde, die Talgründe in der Regel feucht-sumpfig waren, wiederkäuende Haustiere zahlreich auf offenem Land weideten, und vorzüglich ⇒ anthropogene Einflüsse ideale neue Lebensräume für diese Zecken-Art schufen. Genetische Untersuchungen legen nahe, dass die Periode der maximalen Ausbreitungsrate dieser Zecken-Art der Zeitraum von 3 000 bis 500 vChr war, also die Epoche, die in Zentraleuropa vereinfacht als Bronzezeit bezeichnet wird. Eine gewisse Menge an Genfluss zwischen den Populationen von Holzböcken in Nordeuropa lässt sich allerdings schon auf den Einwirkung von Zugvögeln zurückführen. Klar erkennbar ist, dass hauptsächlich ostwärts ziehende Frühjahrszieher Zeckennymphen nach Dänemark, Südnorwegen und -schweden verschleppen. cit. Røed et al. [2016].
Lebensraum: Die Laub- und Mischwaldränder feuchter Täler westlich der Mittelrussischen Platte bis zum Atlantischen Ozean sind der bevorzugte Lebensraum von I. ricinus. Ideal ist ein Klima vom subillyrischen Typ mit einer Vegetationsdauer von etwa 230 Tagen bei 8 bis 9°C Jahresdurchschnittstemperatur. Die Zusammensetzung und die Struktur des Bodens spielen eine untergeordnete Rolle, solange eine dichte Bodenvegetation vorhanden ist und Kleinsäuger zahlreiche vorkommen. Die meisten der bisher genau lokalisierten ⇒ Biotope liegen an Übergangszonen zwischen verschiedenen Vegetationsformen. Es sind durchwegs dauerhaft ⇒ humide ⇒ Habitate mit 80 bis 100% relativer Luftfeuchte, aber niemals Sümpfe. Die Zecken treten bevorzugt an Waldrändern mit angrenzenden Wiesen, Waldlichtungen, Bach- oder Flussauen, Schonungen mit Unterholz und Hecken, Übergängen von Laub- zu Nadelwald und Hoch- zu Niederwald auf. Betroffen sind ebenso Eichen-Hainbuchen- und Buchen-Tannenwälder mit einer gut entwickelten Kraut- und Farnschicht, sowie mit Strauchbeständen von Holunder, Hasel und Brombeeren. In Österreich werden wärmere Südhanglagen mit niedrigem Strauchwerk und Hecken bevorzugt. Die Zecken sammeln sich entlang von Wildwechseln an. Diese Landschaften ziehen viele Erholungssuchende an, insbesondere wenn Bänke, Waldlaufpfade oder Rast- und Beobachtungsplätze vorhanden sind. Manche Autoren glauben daher, dass I. ricinus ein urbaner Zivilisationsgewinner ist, der in der Laubstreu von Parks einen idealen ⇒ anthropogenen Lebensraum gefunden hat. cit. Dautel et Kahl [1999]. Ich denke allerdings, dass I. ricinus zwar bedingt durch das Freizeitverhalten des urbanen Menschen häufiger auf diesem gefunden wird als in früheren Zeiten, davon aber keineswegs profitiert. Kaum eine Zecke, die den Menschen befällt, kommt auch zur nächsten Häutung oder zur Eiablage. Der Befalls des Menschen wirkt sich sehr wahrscheinlich negativ auf die Dichte der Holzbockpopulationen aus, ebenso der von Haus- und Heimtieren wie zB Hunden. Zudem wird diese Zecken-Art durch die zunehmende Trockenheit in Folge der Klimaerwärmung aus ihren optimalen Lebensräumen, den feuchten Flussniederungen, verdrängt. Sie wird zukünftig auf die höher gelegenen, bewaldeten Hänge mit kleinen Bächen ausweichen. Es ist zu vermuten, dass die Gesamtfläche der von dieser Art nutzbaren Habitate schrumpft und die Populationsgrößen daher abnehmen. Eine Ausweitung der kleinräumigen Vorkommen durch intensivere Nutzung urbaner Asphaltwüsten, Parksteppen und Gartenhalbwüsten erscheint mir sehr unwahrscheinlich.
Bionomie: Die Adulten und Nymphen von I. ricinus werden von April bis November, in warmen Jahren bis Mitte Dezember, auf der Vegetation und auf den Wirtstieren angetroffen. Larven findet man von Mai an. Das Verhältnis von nicht-angesogenen Adulten:Nymphen:Larven beträgt in Niederösterreich 1:17:33. cit. Pretzmann et al. [1967]. Die Entwicklungsdauer beträgt zwei Jahre in der Tiefebene um den Neusiedler See, 3 bis 4 Jahre in den mittleren Lagen und bis zu 5 Jahren in der alpinen Zone. Sie
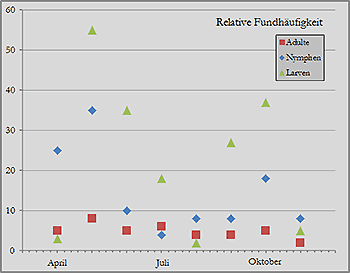 schwankt abhängig von den ⇒ trophischen Verhältnissen, also der Möglichkeit zum Blutsaugen bald nach einer Häutung. I. ricinus überwintert in allen Entwicklungsstadien unter Falllaub und Laubdetritus an Stellen, wo auch im Winter nur Temperaturen bis zu 0°C herrschen und eine relative Luftfeuchtigkeit von mindestens 92% bestehen. Kurzfristig, zB an kalten Wintermorgen, kann die Mindesttemperatur allerdings auch unterschritten werden. Die Eier und die nüchternen Larven sterben unterhalb von -7°C ab. Feuchte Sommer und milde Winter fördern die Individuenstärken der Zecken-Populationen. Die Aktivität der Zecken ist aus mikroklimatischen Gründen nicht immer gleich, die optimalen Verhältnisse bestehen bei Temperaturen über 11°C und einer Luftfeuchtige von 70-80%. Die Zeckenaktivität im Jahresverlauf wird ausgelöst durch ein Ansteigen der Bodentemperatur auf 5 bis 7°C (Monate März/April) und endet im Herbst, sobald die durchschnittliche Lufttemperatur auf etwa den gleichen Wert abgesunken ist (Monate Oktober/November).
schwankt abhängig von den ⇒ trophischen Verhältnissen, also der Möglichkeit zum Blutsaugen bald nach einer Häutung. I. ricinus überwintert in allen Entwicklungsstadien unter Falllaub und Laubdetritus an Stellen, wo auch im Winter nur Temperaturen bis zu 0°C herrschen und eine relative Luftfeuchtigkeit von mindestens 92% bestehen. Kurzfristig, zB an kalten Wintermorgen, kann die Mindesttemperatur allerdings auch unterschritten werden. Die Eier und die nüchternen Larven sterben unterhalb von -7°C ab. Feuchte Sommer und milde Winter fördern die Individuenstärken der Zecken-Populationen. Die Aktivität der Zecken ist aus mikroklimatischen Gründen nicht immer gleich, die optimalen Verhältnisse bestehen bei Temperaturen über 11°C und einer Luftfeuchtige von 70-80%. Die Zeckenaktivität im Jahresverlauf wird ausgelöst durch ein Ansteigen der Bodentemperatur auf 5 bis 7°C (Monate März/April) und endet im Herbst, sobald die durchschnittliche Lufttemperatur auf etwa den gleichen Wert abgesunken ist (Monate Oktober/November).
In gemäßigten Klimaten, in Zentraleuropa, gibt es zwei Jahreszeiten, in der die adulten Tiere und die Nymphen auf Grund der äußeren Verhältnisse besonders aktiv sind: Im Frühjahr, vom April bis in den Juni, und im Frühherbst, im August und September, also ein ⇒ bimodaler Verlauf der Aktivität im Jahreskreis. Es gibt ein deutlich ausgeprägtes Maximum an Aktivität aller Stadien im Frühjahr, in den heißen und trockenen Sommermonaten lässt die Aktivität des Holzbocks an den sonnenexponierten Standorten erkennbar nach, im Herbst steigt sie wieder an. Die Adulten haben ihren Aktivitätshöhepunkt von Mai bis Juni, während die Nymphen ein Monat früher nach Wirtstieren suchen. Die Larven sind üblicherweise in den frühen Sommermonaten aktiv. Eine rasche Erwärmung im Frühjahr fördert die Ko-Existenz von aktiv suchenden Larven und Nymphen, die in normalen Jahren vermieden wird. Ein zweites, kleineres Aktivitätsmaximum aller Entwicklungsstadien tritt von Mitte August bis in den September hinein auf. In warmen Sommern und feuchtwarmen Lagen tritt allerdings ein unimodales ⇒ Aktivitätsmuster auf, das keinen zweiten Gipfel im Herbst erkennen lässt. Dieses vormals auf Südeuropa beschränkte Muster findet sich inzwischen auch in den gemäßigten Klimazonen ⇒ Zentraleuropas.
Entgegen einer weitverbreiteten Meinung sitzen Holzböcke nicht auf den Blättern hoher Bäume, um sich von dort auf ihre Wirte hinunter zu stürzen, sondern sie lauern in der bodennahen Vegetation auf Wirtsorganismen. Es wird zwar behauptet, dass die Larven auf Kräutern und Gräsern bis maximal 30 cm Höhe sitzen, die Nymphen ebendort bis auf ein Meter, und die Adulten auf Kräutern und Büschen bis zu maximal 1,5 m Höhe. I. ricinus soll dabei meist an der Unterseite der Blattspitzen und auf den Spitzen von kleinen Zweigen sitzen. Ich denke allerdings, dass der Sachverhalt deutlich komplexer ist: Zumindest manche Populationen von I. ricinus zeigen nach meiner Ansicht ein deutlich ausgeprägtes Verhalten einer ⇒ ditropischen, vielleicht sogar tritropischen Zecke. Die Larven krabbeln aktiv zur Wirtssuche herum und befallen bevorzugt mäuseartige Kleinsäuger, die Nymphen zeigen einen deutlichen Hang zur ⇒ Omnivorie beim Blutsaugen, sie befallen alle landlebenden Wirbeltiere einschließlich der sonst verschmähten ⇒ Herpetotaxa, und die Adulttiere ziehen die großen, huftragenden Säuger als Blutspender vor, die sie mit Hilfe des Verhaltens der Lauerjagd befallen. Möglicherweise ist dieses, der Art eigene Repertoire an Jagdmethoden der Schlüssel zum unbestreitbaren evolutionären Erfolg dieser Art.
Wirte aller Stadien: Der Holzbock ist ein Generalist und die archetypisch ⇒ telotropische Zecke, dh ihre verschiedenen Lebensstadien parasitieren an unterschiedlichen Wirtstierspektren. Er saugt Blut von über einhundert verschiedenen Arten von Säugetieren, Reptilien und Vögeln. Die von den Larven bevorzugten Kleinsäuger weisen eine hohe Reproduktionsrate mit einem raschen Generationswechsel auf, so dass sie einen ständigen Zuwachs von jungen, für das FSME-Virus empfänglichen Individuen garantieren. Darüber hinaus haben diese Wirte oft auch eine kürzere Lebenserwartung als der Holzbock selbst. Vögel haben nur eine sehr kurze virämische Phase und spielen deshalb als ⇒ Reservoir für das FSME-Virus keine Rolle. Sie dienen jedoch relativ häufig als Wirte für die Jungstadien von I. ricinus und können durch ihre hohe Mobilität zu einer flächendeckenden Verbreitung der Zecke beitragen. Die Adulttiere bevorzugen größere Tiere wie Rinder, Pferde, Schafe, Hunde, Katzen, Hirsche, Rehe, Füchse und Menschen. Die von den Weibchen bevorzugten Großsäuger wiederum spendieren ohne besondere Komplikationen genügend Blut, um eine reichliche und effektive Eiproduktion zu ermöglichen. Größere Wirtstiere werden meist von vielen Holzböcken gleichzeitig befallen. Daher kann die Zahl der sich während einer langdauernden virämischen Phase infizierenden Zecken bemerkenswert hoch sein. Durch ihren großen Aktionsradius tragen große Wirtstiere zudem zur Verbreitung der Zecken bei. Der Mensch wird zwar von dieser Zecken-Art gerne als Wirt akzeptiert, er spielt aber weder als Nahrungs- noch als Infektionsquelle für die Zecke eine wesentliche Rolle. Bei ihm endet die Infektionskette und üblicherweise auch das individuelle Leben des Parasiten.
- Heimische Wirte:
- Wirte aller Stadien:
- Primates: Homo sapiens Linnaeus, 1758 dt: Mensch.
- Artiodactyla: Bos primigenius taurus Linnaeus, 1758 dt: Hausrind.
- Eulipotyphla: Erinaceus europaeus Linnaeus, 1758 dt: Braunbrustigel;
- Erinaceus roumanicus Barrett-Hamilton, 1900 dt: Nördlicher Weißbrustigel.
- Rodentia: Sciurus vulgaris Linnaeus, 1758 dt: Eichhörnchen.
- Wirte ohne Stadienzuordnung:
- Artiodactyla: Bubalus arnee (Kerr, 1792) dt: Wasserbüffel;
- Chiroptera: Rhinolophus ferrumequinum (Schreber, 1774) dt: Große Hufeisennase;
- Myotis myotis Borkhausen, 1797 dt: Großes Mausohr cit. Rupp et al. [2004].
- Carnivora: Martes foina (Erxleben, 1777) dt: Steinmarder;
- Mustela putorius Linnaeus, 1758 dt: Europäischer Iltis;
- Mustela nivalis Linnaeus, 1766 dt: Mauswiesel.
- Galliformes: Phasianus colchicus Linnaeus, 1758 dt: Jagdfasan.
- Squamata: Podarcis muralis (Laurenti, 1768) dt: Mauereidechse.
- Wirte der Larven:
- Eulipotyphla: Neomys fodiens (Pennant, 1771) dt: Wasserspitzmaus;
- Rodentia: Rattus rattus (Linnaeus,1758) dt: Hausratte;
- Rattus norvegicus (Berkenhout, 1769) dt: Wanderratte;
- Apodemius flavicollis (Melchior, 1834) dt: Gelbhalsmaus;
- Apodemus sylvaticus (Linnaeus, 1758) dt: Waldmaus;
- Myodes glareolus (Schreber, 1780) dt: Rötelmaus;
- Arvicola terrestris (Linnaeus, 1758) dt: Ostschermaus;
- Microtus subterraneus (Sélys-Longchamps, 1836) dt: Kurzohrmaus;
- Microtus agrestis (Linnaeus, 1761) dt: Erdmaus;
- Chionomys nivalis Martins, 1842 dt: Schneemaus.
- Anseriformes: Anas platyrhynchos Linnaeus, 1758 dt: Hausente.
- Accipitriformes: Buteo buteo (Linnaeus, 1758) dt: Mäusebussard.
- Gruiformes: Fulica atra Linnaeus, 1758 dt: Blässhuhn.
- Cuculiformes: Cuculus canorus (Linnaeus, 1758) dt: Kuckuck.
- Strigiformes: Asio otus (Linnaeus, 1758) dt: Waldohreule.
- Piciformes: Dendrocops medius (Linnaeus, 1758) dt: Mittelspecht.
- Passeriformes: Anthus trivialis Linnaeus, 1758 dt: Baumpiper;
- Troglodytes troglodytes (Linnaeus, 1758) dt: Zaunkönig;
- Prunella modularis (Linnaeus, 1758) dt: Heckenbraunelle;
- Luscinia megarhynchos Brehm, 1831 dt: Nachtigall;
- Phoenicurus phoenicurus (Linnaeus, 1758) dt: Gartenrotschwanz;
- Turdus pilaris Linnaeus, 1758 dt: Wacholderdrossel;
- Turdus philomelos Brehm, 1831 dt: Singdrossel;
- Turdus iliacus Linnaeus, 1758 dt: Rotdrossel;
- Sylvia borin (Boddaert, 1783) dt: Gartengrasmücke;
- Phylloscopus sibilatrix (Bechstein, 1793) dt: Waldlaubsänger;
- Phylloscopus collybita (Vieillot, 1817) dt: Zilpzalp;
- Ficedula hypoleuca (Pallas, 1764) dt: Trauerschnäpper;
- Poecile montanus (Conrad von Baldenstein, 1827) dt: Weidenmeise;
- Lophophanes cristatus (Linnaeus, 1758) dt: Haubenmeise;
- Pica pica (Linnaeus, 1758) dt: Elster;
- Nucifraga caryocatactes (Linnaeus, 1758) dt: Tannenhäher;
- Corvus frugilegus Linnaeus, 1758 dt: Saatkrähe;
- Passer montanus (Linnaeus, 1758) dt: Feldsperling;
- Carduelis spinus Linnaeus, 1758 dt: Erlenzeisig;
- Carduelis chloris Linnaeus, 1758 dt: Grünfink;
- Carpodacus erythrinus Pallas, 1770 dt: Karmingimpel;
- Pyrrhula pyrrhula (Linnaeus, 1758) dt: Gimpel.
- cit. Siuda et al. (2006)
- Wirte der Larven und der Nymphen:
- Carnivora: Felis silvestris silvestris Schreber, 1775 dt: Wildkatze;
- Felis sylvestris f. catus (Linnaeus, 1758) dt: Hauskatze.
- Eulipotyphla: Talpa europaea Linnaeus, 1758 dt: Maulwurf;
- Sorex minutus Linnaeus, 1766 dt: Zwergspitzmaus;
- Sorex araneus Linnaeus, 1758 dt: Waldspitzmaus;
- Sorex alpinus Schinz 1837 dt: Alpenspitzmaus;
- Crocidura suaveolens (Pallas, 1811) dt: Gartenspitzmaus;
- Lagomorpha: Lepus europaeus Pallas, 1778 dt: Feldhase.
- Rodentia: Microtus arvalis (Pallas, 1778) dt: Feldmaus;
- Glis glis (Linnaeus, 1766) dt: Siebenschläfer;
- Passeriformes: Turdus merula Linnaeus, 1758 dt: Amsel;
- Poecile palustris (Linnaeus, 1758) dt: Sumpfmeise;
- Parus major Linnaeus, 1758 dt: Kohlmeise;
- Lanius collurio Linnaeus, 1758 dt: Neuntöter;
- Periparus ater Linnaeus, 1758 dt: Tannenmeise;
- Emberiza citrinella Linnaeus, 1758 dt: Goldammer;
- Sturnus vulgaris Linnaeus, 1758 dt: Star;
- Fringilla coelebs Linnaeus, 1758 dt: Buchfink;
- Cyanistes caeruleus (Linnaeus, 1758) dt: Blaumeise;
- Garrulus glandarius (Linnaeus, 1758) dt: Eichelhäher;
- Sitta europaea (Linnaeus, 1758) dt: Kleiber;
- Erithacus rubecula (Linnaeus, 1758) dt: Rotkehlchen;
- Phylloscopus trochilus Linnaeus, 1758 dt: Fitis.
- Squamata: Lacerta agilis Linnaeus, 1758 dt: Zauneidechse;
- Lacerta viridis (Laurenti, 1768) dt: Östliche Smaragdeidechse;
- Zootoca vivipara (Lichtenstein, 1823) dt: Mooreidechse. cit. Nowak-Chmura et Siuda [2012].
- Wirte der Nymphen:
- Carnivora: Mustela erminea Linnaeus, 1758 dt: Hermelin;
- Mustela putorius Linnaeus, 1758 dt: Europäischer Iltis.
- Eulipotyphla: Talpa europaea Linnaeus, 1758 dt: Maulwurf;
- Sorex alpinus Schinz, 1837 dt: Alpenspitzmaus;
- Neomys fodiens (Pennant, 1771) dt: Wasserspitzmaus;
- Sorex minutus Linnaeus, 1766 dt: Zwergspitzmaus;
- Sorex araneus Linnaeus, 1758 dt: Waldspitzmaus;
- Crocidura leucodon (Hermann, 1780) dt: Feldspitzmaus.
- Rodentia: Apodemus flavicollis (Melchior, 1834) dt: Gelbhalsmaus;
- Apodemus sylvaticus (Linnaeus, 1758) dt: Waldmaus;
- Myodes glareolus (Schreber, 1780) dt: Rötelmaus;
- Arvicola terrestris (Linnaeus, 1758) dt: Ostschermaus;
- Microtus subterraneus (Sélys-Longchamps, 1836) dt: Kurzohrmaus;
- Microtus agrestis (Linnaeus, 1761) dt: Erdmaus;
- Chionomys nivalis Martins, 1842 dt: Schneemaus.
- Chiroptera: Pipistrellus pipistrellus (Schreber, 1774) dt: Zwergfledermaus.
- Piciformes: Dendrocopos major (Linnaeus, 1758) dt: Buntspecht;
- Picus viridis (Linnaeus, 1758) dt: Grünspecht.
- Passeriformes: Acrocephalus scirpaceus (Hermann, 1804) dt: Teichrohrsänger;
- Acrocephalus schoenobaenus (Linnaeus, 1758) dt: Schilfrohrsänger;
- Acrocephalus arundinaceus (Linnaeus, 1758) dt: Drosselrohrsänger;
- Locustella fluviatilis (Wolf, 1810) dt: Schlagschwirl;
- Aegithalos caudatus (Linnaeus, 1758) dt: Schwanzmeise
- Sylvia atricapilla (Linnaeus, 1758) dt: Mönchsgrasmücke;
- Ficedula albicollis (Temminck, 1815) dt: Halsbandschnäpper;
- Squamata: Anguis fragilis Linnaeus, 1758 dt: Blindschleiche;
- Coronella austriaca Laurenti, 1768 dt: Schlingnatter;
- Zamenis longissimus (Laurenti, 1768) dt: Äskulapnatter;
- Natrix natrix (Linnaeus, 1758) dt: Ringelnatter, sehr wahrscheinlich eine Fehlbestimmung;
- Wirte der Nymphen und Adulte:
- Artiodactyla: Cervus elaphus Linnaeus, 1758 dt: Rothirsch;
- Sus scrofa Linnaeus, 1758 dt: Wildschwein;
- Capreolus capreolus (Linnaeus, 1758) dt: Reh cit. Schebek [2013].
- Carnivora: Vulpes vulpes (Linnaeus, 1758) dt: Rotfuchs cit. Schebek [2013]. Rodentia: Apodemus flavicollis (Melchior, 1834) dt: Gelbhalsmaus;
- Apodemus sylvaticus (Linnaeus, 1758) dt: Waldmaus;
- Wirte der Adulttiere:
- Carnivora: Canis lupus familiaris (Linnaeus, 1758) dt: Haushund;
- Felis silvestris silvestris Schreber, 1775 dt: Europäische Wildkatze;
- Felis silvestris catus (Linnaeus, 1758) dt: Hauskatze;
- Martes martes (Linnaeus, 1758) dt: Edelmarder;
- Meles meles (Linnaeus, 1758) dt: Europäischer Dachs.
- Artiodactyla: Capra aegagrus hircus Erxleben, 1777 dt: Hausziege;
- Ovis orientalis aries Linnaeus, 1758 dt: Hausschaf;
- Dama dama Linnaeus, 1758 dt: Damhirsch;
- Ovis orientalis orientalis Gmelin, 1774 dt: Moufflon.
- Perissodactyla: Equus ferus caballus Linnaeus, 1758 dt: Hauspferd.
- Lagomorpha: Lepus europaeus Pallas, 1778 dt: Feldhase cit. Schebek [2013]);
- Oryctolagus cuniculus (Linnaeus, 1758) dt: Kaninchen.
- Rodentia: Myodes glareolus (Schreber, 1780) dt: Rötelmaus;
- Microtus arvalis (Pallas, 1778) dt: Feldmaus.
Erregerfunktion: Die langen Mundwerkzeuge der Weibchen führen zu erheblichen ⇒ Belästigungen beim Stich und zum Abreißen des ⇒ Capitulums im Zuge eines unsachgemäßen Entfernens. Beim erwachsenen Menschen wird die überwiegende Anzahl der Zeckenstiche an den Beinen, in der Gesäß- und in der Genitalregion beobachtet. Bei Kindern treten etwa 75% der Zeckenstiche am Kopf auf, die restlichen verteilen sich auf Beine und Arme, Rumpf, Gesäß- und Genitalregion. Der Grund für die ungleiche Verteilung könnte im unterschiedlichen Verhalten der Altersgruppen liegen.
Vektorfunktion: I. ricinus fungiert als spezifischer ⇒ Überträger, ⇒ Vektor und/oder ⇒ Reservoir für eine nennenswerte Anzahl an humanpathogenen Erregern. In einer immer aktualisierten Liste werden folgende Erreger genannt:
Das FSME-Virus, der Erreger der Frühsommer-Meningoenzephalitis;
das Louping-ill-Virus, der Erreger der ovinen Springkrankheit, von dem auch humane Infektionen bekannt sind;
das Eyach-Virus, der Erreger des Eyach-Virus Fiebers;
das Erve-Virus, der Erreger des Erve-Virus Fiebers;
das Tribec-Virus, der vermutete Erreger einer Meningoenzephalitis;
das Lipovnik-Virus, der vermutete Erreger einer Meningoenzephalitis;
das Uukuniemi-Virus, der Erreger einer Enzephalitis;
das Kemerovo-Virus, der Erreger des Kemerovo tickborne viral Fiebers;
das BHF-Virus, der Erreger des Bukhovinian hämorrhagischen Fiebers;
Borrelia afzelii Canica et al., 1994, det Erreger einer Hautborreliose;
Borrelia garinii Baranton et al., 1992, der Erreger der Neuroborreliose;
Borrelia lusitaniae Le Fleche et al., 1997, der Erreger einer Lyme-Borreliose;
Borrelia miyamotoi Fukunaga et al., 1995,, der Erreger eines Rückfallfiebers;
Borrelia valaisiana Wang et al., 1997, der vermutete Erreger einer Lyme-Borreliose;
Borrelia spielmanii Richter et al., 2006, der Erreger einer Lyme-Borreliose;
Borrelia burgdorferi Johnson et al., 1984 emend. Baranton et al., der Erreger der Lyme-Borreliose;
Rickettsia helvetica Beati et al., 1993, ein unbestätigter Erreger einer Meningitis;
Rickettsia monacensis Simser et al., 2002, eine Rickettsia mit unbekannter Erregerpotenz;
Anaplasma phagocytophilum (Foggie, 1949) Dumler et al., 2001, der Erreger der Granulozytären Ehrlichiose;
Anaplasma marginale (Theiler, 1910), der Erreger einer bovinen Anaplasmose;
Candidatus Neoehrlichia mikurensis Kawahara et al., 2004, der Erreger der Neoehrlichiose;
Coxiella burneti (Derrick, 1939), der Erreger des Q-Fiebers;
Francisella tularensis (McCoy et Chapin, 1912), der Erreger der Tularämie;
Babesia divergens (’Fadyean et Stockman, 1911);
Babesia bovis (Babés, 1888), dem Erreger der redwater disease des Viehs,
Babesien des Stammes EU-1,
Theileria microti (Franca, 1912), der Erreger einer Babesiose.
Ixodes rugicollis Schulze et Schlottke, 1929
Diese Ixodes-Art ist schlecht dokumentiert, wird selten aufgefunden oder es wird selten an sie gedacht, und ihre Bionomie ist ein wenig rätselhaft. Diese Art ist allerdings der einzige Erstnachweis einer Zecken-Art in Österreich seit den Untersuchungen von Sixl in den frühen 1970-er Jahren. Sie wurde im Februar 2010 auf einem Steinmarder nahe Kufstein entdeckt, eine Winteraktivität dieser Art erscheint daher naheliegend zu sein. Bedauerlicherweise kann an Hand des Belegfotos in dieser Publikation eine Verwechslung mit I. (Pholeoixodes) canisuga nicht nur nicht ausgeschlossen werden, sie ist sogar ziemlich wahrscheinlich. cit. Visser et al. [2011]. Die folgenden Abbildungen sind in stark veränderter Form einer Wiederbeschreibung der Art in Polen entnommen. cit. Siuda et al. [2010].
Synonyme:
I. cornutus Lototsky, 1956; dies könnte aber auch eine gute Art sein.
Pholeoixodes rugicollis Morel et Aubert, 1975.
Weibchen:  Das vollgesogene Weibchen ist im Umriss länglich, die Farbe ist braunrot. Charakteristisch für diese Art sind die dreieckigen Auswüchse an der ⇒ Basis capituli auf beiden Seiten des ⇒ Hypostoms (siehe Bild rechts). Auf der Dorsalseite ist der Hinterrand der Basis capituli leicht ⇒ konkav geschwungen. Die hinteren Winkel sind rechtwinkelig oder leicht stumpfwinkelig. ⇒ Cornua gibt es keine. Die ⇒ Areae porosae sind rund in dreieckigen Vertiefungen gelagert. Die ⇒ Palpen sind kurz und gedrungen, das zweite Glied ist länger als das dritte. Der Schild verjüngt sich nach hinten und ist unregelmäßig geformt, er ist gleich in Breite und Länge (1,3 mm), der hintere Rand ist rund. Die Zervikalfalten sind unregelmäßige Bögen und erreichen den Schildrand. In den Seitenfeldern findet sich eine Streifenzeichnung. Eine Punktierung ist nur am vorderen und am hinteren Rand zu erkennen.
Das vollgesogene Weibchen ist im Umriss länglich, die Farbe ist braunrot. Charakteristisch für diese Art sind die dreieckigen Auswüchse an der ⇒ Basis capituli auf beiden Seiten des ⇒ Hypostoms (siehe Bild rechts). Auf der Dorsalseite ist der Hinterrand der Basis capituli leicht ⇒ konkav geschwungen. Die hinteren Winkel sind rechtwinkelig oder leicht stumpfwinkelig. ⇒ Cornua gibt es keine. Die ⇒ Areae porosae sind rund in dreieckigen Vertiefungen gelagert. Die ⇒ Palpen sind kurz und gedrungen, das zweite Glied ist länger als das dritte. Der Schild verjüngt sich nach hinten und ist unregelmäßig geformt, er ist gleich in Breite und Länge (1,3 mm), der hintere Rand ist rund. Die Zervikalfalten sind unregelmäßige Bögen und erreichen den Schildrand. In den Seitenfeldern findet sich eine Streifenzeichnung. Eine Punktierung ist nur am vorderen und am hinteren Rand zu erkennen.
 Ventralseite: Das Hypostom ist spitz lanzettförmig und trägt zehn oder elf Seitenzähne. Neben den unteren sechs Seitenzähnen sitzen je ein, neben den oberen je zwei, spitze Innenzähne. Die Spirakularplatten sind unregelmäßig gerundet, klein und von der Größe des Analrings. Die ⇒ Coxen des ersten, vielleicht auch des zweiten Beinpaares mit leicht aufgewölbten inneren Winkeln, dh sie sind zugespitzt. Die äußeren Dornen fehlen auf allen Coxen oder sie sind sehr unauffällig. Die Einbuchtung vor dem Haller`schen Organ ist sehr markant.
Ventralseite: Das Hypostom ist spitz lanzettförmig und trägt zehn oder elf Seitenzähne. Neben den unteren sechs Seitenzähnen sitzen je ein, neben den oberen je zwei, spitze Innenzähne. Die Spirakularplatten sind unregelmäßig gerundet, klein und von der Größe des Analrings. Die ⇒ Coxen des ersten, vielleicht auch des zweiten Beinpaares mit leicht aufgewölbten inneren Winkeln, dh sie sind zugespitzt. Die äußeren Dornen fehlen auf allen Coxen oder sie sind sehr unauffällig. Die Einbuchtung vor dem Haller`schen Organ ist sehr markant.
Männchen: Auf der Bauchseite liegen an den beiden hinteren Lateralränder der trapezförmigen ⇒ Basis capituli Felder mit feinen, konischen Borsten (⇒ Setae). Die Basis capituli hat keine ⇒ Cornua. Die Bezahnung am Hypostom ist reduziert, das Hypostom selbst ist zungenförmig mit einer breiten, dreieckigen Vertiefung an der Spitze. Die bauchseitige Mittelplatte ist hexagonal im Umriss. Vorne endet die Analplatte mit einer geraden Begrenzung. Die Spirakularplatten sind beinahe rund kleiner als der Analring. An den ⇒ Coxen des ersten Beinpaares fehlen die Innendornen. Die Außendornen aller Coxen sind kurze, kleine und abgerundete Auswüchse.
 Nymphe:
Nymphe:  Der dorsale hintere Rand der ⇒ Basis capituli ist leicht ⇒ konvex geformt, fast gerade. Die Winkel zwischen den Lateral- und dem Hinterrand sind rechte, An der Basis capituli finden sich niemals ⇒ Cornua. Das Hypostom ist zungenförmig, an der Basis am breitesten. Sechs Lateralzähne sitzen am Hypostom. Das Schild ist herzförmig, breiter (0,59 mm) als lang (0,5 mm), am breitesten in der Mitte. Die Scutalborsten (Setae) sind so lang wie die zentralen Rückenborsten und kürzer als die seitlichen Rückenborsten. Die Spirakularplatten sind unregelmäßig rund nicht größer als der Analring. An den ⇒ Coxen des ersten Beinpaares fehlt der Innendorn, an allen Coxen fehlen die Außendornen.
Der dorsale hintere Rand der ⇒ Basis capituli ist leicht ⇒ konvex geformt, fast gerade. Die Winkel zwischen den Lateral- und dem Hinterrand sind rechte, An der Basis capituli finden sich niemals ⇒ Cornua. Das Hypostom ist zungenförmig, an der Basis am breitesten. Sechs Lateralzähne sitzen am Hypostom. Das Schild ist herzförmig, breiter (0,59 mm) als lang (0,5 mm), am breitesten in der Mitte. Die Scutalborsten (Setae) sind so lang wie die zentralen Rückenborsten und kürzer als die seitlichen Rückenborsten. Die Spirakularplatten sind unregelmäßig rund nicht größer als der Analring. An den ⇒ Coxen des ersten Beinpaares fehlt der Innendorn, an allen Coxen fehlen die Außendornen.
Larve: Der dorsale hintere Rand der ⇒ Basis capituli ist im zentralen Bereich leicht ⇒ konvex geformt. An der Basis capituli sitzen nie ⇒ Cornua. Das Hypostom ist breit, zungenförmig und mit einer breit gerundeten Spitze. Sechs Lateralzähne. Das Schild ist herzförmig, deutlich breiter (0,35 mm) als lang (0,28 mm). Die Seitenränder sind leicht ⇒ konkav gebogen oder gerade, und länger als der Vorderrand. Neun Paar seitliche Rückenborsten, die etwa 1,3-mal länger sind als die Scutalborsten. Die ⇒ Coxen haben runde Innenwinkel, an allen Coxen fehlen die Dornen.
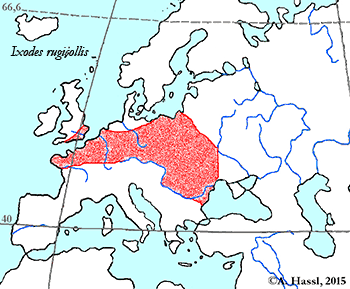 Verbreitung & Bionomie: I. rugicollis scheint in ⇒ Zentraleuropa selten aufgefunden zu werden, obgleich diese Zecke wahrscheinlich gar nicht selten ist. Die Verbreitung umfasst zumindest Polen, Österreich, Deutschland, Nordost-Frankreich, Rumänien, und die Schweiz, vermutlich aber auch die ehemalige CSSR und Ungarn. Angeblich sind die Hauptwirte frei-lebende Säugetiere der Gattung Mustela, das sind Wiesel. Folgt man den Angaben der Erstbeschreibung, so handelt es sich um eine Baum- und Bodenhöhlen bewohnende, also um ein kavernikole Zecke. Es scheint sich aber eher um eine Zecke mit einer Bevorzugung von Hausraubsäugetiere zu handeln. In diesem Fall wird diese Zecke wohl kaum in Baumhöhlen nach ihren derzeitigen Vorzugswirten, Hunde und Katzen, suchen. Vielleicht handelt es sich um einen Kulturfolger, zumindest aber einen Zivilisationsgewinner, der allerdings wahrscheinlich nicht ⇒ ubiquitär in Städten auftritt. Alternativ erscheint mir aber die These einleuchtender, dass es sich um eine Reliktart aus der Zeit der hohen ⇒ Abundanz von höhlennutzenden Großraubtieren in Europa (Höhlenlöwe, Hyänen, Bären, vielleicht auch die Säbelzahnkatzen) handelt. Ausgehend von dieser Annahme erscheinen aber frühere Angaben zur Verbreitung unvollständig zu sein, die wenigen ⇒ ökologischen Daten unzuverlässig zu sein und die berichtete Häufigkeit dieser Zecke unterrepräsentierend.
Verbreitung & Bionomie: I. rugicollis scheint in ⇒ Zentraleuropa selten aufgefunden zu werden, obgleich diese Zecke wahrscheinlich gar nicht selten ist. Die Verbreitung umfasst zumindest Polen, Österreich, Deutschland, Nordost-Frankreich, Rumänien, und die Schweiz, vermutlich aber auch die ehemalige CSSR und Ungarn. Angeblich sind die Hauptwirte frei-lebende Säugetiere der Gattung Mustela, das sind Wiesel. Folgt man den Angaben der Erstbeschreibung, so handelt es sich um eine Baum- und Bodenhöhlen bewohnende, also um ein kavernikole Zecke. Es scheint sich aber eher um eine Zecke mit einer Bevorzugung von Hausraubsäugetiere zu handeln. In diesem Fall wird diese Zecke wohl kaum in Baumhöhlen nach ihren derzeitigen Vorzugswirten, Hunde und Katzen, suchen. Vielleicht handelt es sich um einen Kulturfolger, zumindest aber einen Zivilisationsgewinner, der allerdings wahrscheinlich nicht ⇒ ubiquitär in Städten auftritt. Alternativ erscheint mir aber die These einleuchtender, dass es sich um eine Reliktart aus der Zeit der hohen ⇒ Abundanz von höhlennutzenden Großraubtieren in Europa (Höhlenlöwe, Hyänen, Bären, vielleicht auch die Säbelzahnkatzen) handelt. Ausgehend von dieser Annahme erscheinen aber frühere Angaben zur Verbreitung unvollständig zu sein, die wenigen ⇒ ökologischen Daten unzuverlässig zu sein und die berichtete Häufigkeit dieser Zecke unterrepräsentierend.
Wirte aller Stadien: Vermutlich nur Kleinraubsäuger, insbesondere Hunde und Katzen. Dieses Wirtsspektrum könnte aber auf das ⇒ postglaziale Aussterben der Großraubsäuger in Europa zurückzuführen sein.
- Heimische Wirte:
- Carnivora: Canis lupus familiaris (Linnaeus, 1758) dt: Haushund;
- Felis sylvestris f. catus (Linnaeus, 1758) dt: Hauskatze;
- Martes foina (Erxleben, 1777) dt: Steinmarder;
- Mustela nivalis Linnaeus, 1766 dt: Mauswiesel;
- Meles meles (Linnaeus, 1758) dt: Europäischer Dachs.
Erreger- und Vektorfunktion: Nicht bekannt.
Ixodes (Eschatocephalus) simplex Neumann, 1906
en: Bat tick
Diese Ixodes-Art wurde in Österreich noch nie nachgewiesen. In den Nachbarländern wird sie jedoch so regelmäßig an Fledermäusen gefunden, dass kein Zweifel an ihrer ⇒ Autochthonität und ihrem hiesigen Vorkommen besteht. Die Männchen sind nach wie vor nicht bekannt, vielleicht gibt es gar keine. Die Bionomie der Art ist schlecht erforscht und strittig. Und dies, obgleich aus dem Jahre 1956 eine monumentale Monographie der Fledermauszecken mit einer detaillierten Beschreibung dieser Art vorliegt. cit. Arthur [1956]. Dieser Art wird nachgesagt, dass sie einen bevorzugten Wirt hat, die troglo- und thermophile Langflügelfledermaus, aber auch anders lebende Fledermausspezies befällt. Bei Studium der Literatur ist mit zahlreichen Fehlangaben und nomenklatorischen Fehlern zu rechnen.
Synonyme:
Eschatocephalus simplex Neumann, 1906;
I. simplex simplex Neumann, 1906;
I. audyi Kohls, 1955;
I. spiculae Arthur, 1956;
I. simplex africanus Arthur, 1956;
I. africanus Arthur, 1956;
I. pospelovae Emchuk, 1956;
I. chiropterorum Babos et Janisch, 1958.
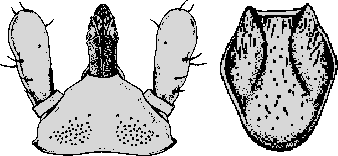 Weibchen: Der Körper des nüchternen Weibchens ist breit oval, 4,4 bis 4,6 mm lang und 4,3 bis 4,5 mm breit und auf der Höhe der Spirakularplatten am breitesten. Das Scutum bedeckt ⅓ des Körpers. Das Scutum ist mittel- bis dunkelbraun glänzend, länger als breit, 1,12 bis 1,17 mm lang und 0,79 bis 0,89 mm breit. Es ist am breitesten leicht ⇒ anterior der halben Länge, es verengt sich deutlich nach hinten und endet in einem gekrümmten hinteren Rand. Die antero-lateralen Ränder sind ⇒ konkav gebogen, die postero-lateralen gerade oder leicht ⇒ konvex geformt. Die Sklerotisierung kann etwas unregelmäßig sein. Die Punktierung ist fein, spärlich und verstreut. Nur wenige, kurze Borsten stehen in den antero-lateralen und ⇒ anterioren Feldern. Die Scapulae sind sehr klein, kurz, mehr abgerundete Höcker. Die Zervikalfurchen sind schwach angedeutet, aber vorhanden, sie ziehen sich fast bis zum postero-lateralen Rand. Der Körper ist mit markanten, relativ langen, hellen Borsten auf dem ⇒ Alloscutum bedeckt. Diese stehen dorsal dicht, insbesondere seitlich, ventral hingegen eher spärlich. Die postero-laterale und mediane Furchen sind schlecht erkennbar. Die ⇒ Basis capituli ist etwas breiter als lang, 0,4 bis 0,5 mm lang und an der dorsalen Basis 0,38 bis 0,4 mm breit. In der Ventralansicht ist sie fünfeckig. Dorsal ist sie im mittleren Bereich abgeflacht, zu den Basen der ⇒ Palpen hin sanft gebogen, antero-lateral stark ⇒ konvex gekrümmt. Der Hinterrand ist in der Regel gerade oder gering konkav oder konvex gebogen, ⇒ median erhöht. Die Basis capituli ist frei von ⇒ Cornua. Die postero-lateralen Winkeln sind leicht gebogen. Die ⇒ Areae porosae, bestehend aus weit verstreuten Poren in einer subzirkularen Depression des Integuments, sind groß und durch einen sehr schmalen Abstand getrennt. Posterior der ⇒ Palpen gibt es seitlich einen unverwechselbaren, halbmondförmigen, membranösen Bereich. Die ⇒ Palpen sind kurz und keulenförmig, am breitesten nahe dem distalen Ende, ⇒ proximal sind sie schmal, 0,33 mm lang und maximal 0,12 mm breit. Die ⇒ Palpen sind auf den Flächen, die zur Mittellinie hin gerichtet sind, abgeflacht bis auf eine leichte Einbuchtung dorsal zum Glied IV. Die Profillinien sind sanft gekrümmte oder gerade, sowohl seitlich und hin zur Mittellinie. Stärker gekrümmt sind sie zur Mittellinie hin zur Spitze des Gliedes III. Die Nahtlinie zwischen den Gliedern II und III ist undeutlich und 0,14 mm lang. Das Glied I ist breit und nach antero-lateral gerichtet, das Glied II ist 0,16 bis 0,17 mm lang, das Glied III 0,14 bis 0,15 mm. Auf den ⇒ Palpen sitzen nur wenige und kurze Borsten. Das ⇒ Hypostom ist stumpf an der Spitze und 0,18 mm in der Länge. Die Bezahnung besteht von der Basis gezählt aus Zahnreihen mit den Anordnungen: Eine Reihe 4-4, vier distale Reihen 3-3, die ⇒ apikale Reihen mit immer kleineren Zähnen, zwei Reihen 2-2 und eine Reihe 1-1.
Weibchen: Der Körper des nüchternen Weibchens ist breit oval, 4,4 bis 4,6 mm lang und 4,3 bis 4,5 mm breit und auf der Höhe der Spirakularplatten am breitesten. Das Scutum bedeckt ⅓ des Körpers. Das Scutum ist mittel- bis dunkelbraun glänzend, länger als breit, 1,12 bis 1,17 mm lang und 0,79 bis 0,89 mm breit. Es ist am breitesten leicht ⇒ anterior der halben Länge, es verengt sich deutlich nach hinten und endet in einem gekrümmten hinteren Rand. Die antero-lateralen Ränder sind ⇒ konkav gebogen, die postero-lateralen gerade oder leicht ⇒ konvex geformt. Die Sklerotisierung kann etwas unregelmäßig sein. Die Punktierung ist fein, spärlich und verstreut. Nur wenige, kurze Borsten stehen in den antero-lateralen und ⇒ anterioren Feldern. Die Scapulae sind sehr klein, kurz, mehr abgerundete Höcker. Die Zervikalfurchen sind schwach angedeutet, aber vorhanden, sie ziehen sich fast bis zum postero-lateralen Rand. Der Körper ist mit markanten, relativ langen, hellen Borsten auf dem ⇒ Alloscutum bedeckt. Diese stehen dorsal dicht, insbesondere seitlich, ventral hingegen eher spärlich. Die postero-laterale und mediane Furchen sind schlecht erkennbar. Die ⇒ Basis capituli ist etwas breiter als lang, 0,4 bis 0,5 mm lang und an der dorsalen Basis 0,38 bis 0,4 mm breit. In der Ventralansicht ist sie fünfeckig. Dorsal ist sie im mittleren Bereich abgeflacht, zu den Basen der ⇒ Palpen hin sanft gebogen, antero-lateral stark ⇒ konvex gekrümmt. Der Hinterrand ist in der Regel gerade oder gering konkav oder konvex gebogen, ⇒ median erhöht. Die Basis capituli ist frei von ⇒ Cornua. Die postero-lateralen Winkeln sind leicht gebogen. Die ⇒ Areae porosae, bestehend aus weit verstreuten Poren in einer subzirkularen Depression des Integuments, sind groß und durch einen sehr schmalen Abstand getrennt. Posterior der ⇒ Palpen gibt es seitlich einen unverwechselbaren, halbmondförmigen, membranösen Bereich. Die ⇒ Palpen sind kurz und keulenförmig, am breitesten nahe dem distalen Ende, ⇒ proximal sind sie schmal, 0,33 mm lang und maximal 0,12 mm breit. Die ⇒ Palpen sind auf den Flächen, die zur Mittellinie hin gerichtet sind, abgeflacht bis auf eine leichte Einbuchtung dorsal zum Glied IV. Die Profillinien sind sanft gekrümmte oder gerade, sowohl seitlich und hin zur Mittellinie. Stärker gekrümmt sind sie zur Mittellinie hin zur Spitze des Gliedes III. Die Nahtlinie zwischen den Gliedern II und III ist undeutlich und 0,14 mm lang. Das Glied I ist breit und nach antero-lateral gerichtet, das Glied II ist 0,16 bis 0,17 mm lang, das Glied III 0,14 bis 0,15 mm. Auf den ⇒ Palpen sitzen nur wenige und kurze Borsten. Das ⇒ Hypostom ist stumpf an der Spitze und 0,18 mm in der Länge. Die Bezahnung besteht von der Basis gezählt aus Zahnreihen mit den Anordnungen: Eine Reihe 4-4, vier distale Reihen 3-3, die ⇒ apikale Reihen mit immer kleineren Zähnen, zwei Reihen 2-2 und eine Reihe 1-1.
Die Spirakularplatten sind subzirkular oder breitoval, der Vorderrand etwas abgeflacht. Die Längsachse liegt quer zu der des Körpers. Die Größe ist 0,24 von 0,27 mm. Die Beine haben eine mittlere Länge. An den ⇒ Coxen fehlen die Dornen. Die Tarsi verlaufen mit parallelen Seiten über den größten Teil ihrer Länge, nur der Tarsus I verjüngt sich beim Haller`schen Organ allmählich zur Spitze. Der Tarsus I ist 0,73 bis 0,79 mm lang; der Metatarsus I 0,65 mm; der Tarsus IV 0,74 bis 0,78 und der Metatarsus IV 0,67.
Die ⇒ Genitalöffnung liegt zwischen den Coxen III. Die Analfalten sind sehr kurz, vorne Spitzbogen-förmig, hinten deutlich divergierend.
Männchen: Nicht bekannt.
Nymphe: 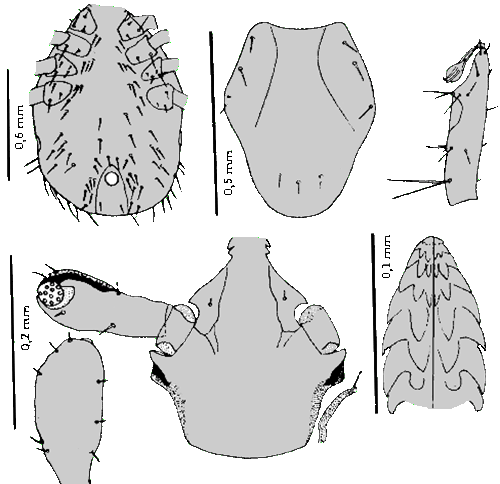 Die Körpermaße der vollgesogenen Nymphe betragen 2,3 bis 2,6 mm mal 1,8 bis 2,3 mm. Auf dem Körper verstreut blassen Haare. Die sklerotisierten Teile sind hellbraun. Das ⇒ Capitulum ist 0,30 bis 0,32 mm lang und dorsal an der Basis 0,26 mm breit. Der postero-laterale Rand ist gerade oder leicht ⇒ konvex geformt, die postero-lateralen Ecken sind abgerundet, Die ⇒ Basis capituli ist frei von ⇒ Cornua.
Die Körpermaße der vollgesogenen Nymphe betragen 2,3 bis 2,6 mm mal 1,8 bis 2,3 mm. Auf dem Körper verstreut blassen Haare. Die sklerotisierten Teile sind hellbraun. Das ⇒ Capitulum ist 0,30 bis 0,32 mm lang und dorsal an der Basis 0,26 mm breit. Der postero-laterale Rand ist gerade oder leicht ⇒ konvex geformt, die postero-lateralen Ecken sind abgerundet, Die ⇒ Basis capituli ist frei von ⇒ Cornua.
Das Scutum ist länger als es breit ist, 0,53 bis 0,61 mm zu 0,46 bis 0,52 mm. Am breitesten ist es leicht ⇒ anterior der halben Länge. Seine Oberfläche ist glänzend, die Punktierung fein und gleichmäßig verteilt. Die Zervikalfurchen sind deutlich ausgeprägt. Zuerst verlaufen sie konvergenten und dann, in Richtung des dorso-lateralen Randes, divergent. Sie verschwinden erst knapp vor dem Erreichen des Randes. Borstenhaare (⇒ Setae) sind nur wenige vorhanden. Die Scapulae sind gerundet und sehr kurz, ihre Einkerbung ist sehr flach. Die ⇒ Basis capituli ist breit, ihre Seitenränder sind kurz, gekrümmt und konvergierend. Sie besitzt ventral eine milde Taille und kaum erkennbare oder keine ⇒ Auriculae. Der Hinterrand ist etwas abgerundet. Die Oberfläche ist leicht ⇒ konvex gebogen, glatt, ohne Punktierung. Die ⇒ Palpen haben eine ziemlich regelmäßige Oberfläche, außen sind sie fast gerade, innen hingegen gebogen und leicht verengt. Die ⇒ Palpen tragen wenige und kurze Haare. Das Glied I ist gerundet und schmal, die Glieder II und III trennt eine undeutlich zu erkennende Naht, sie sind schmal an der Basis und dehnen sich nach distal allmählich aus. Sie sind zusammen 0,16 bis 0,18 mm lang, das Glied III ist etwa 0,09 mm lang. Die größte Breite des Palpus ist 0,07 mm, gemessen nahe der Spitze. Das Hypostom ist am breitesten nahe der Basis, es hat gebogene Profillinien, die zu einem stumpfen Punkt ⇒ apikal zusammenlaufen. Die Länge beträgt etwa 0,12 mm. Die Zahnreihen vom Scheitel an gezählt: Eine Reihe 4-4 oder 3-3, drei Reihen 3-3, drei Reihen 2-2 und eine Reihe 1-1.
Die Analfalten verlaufen nur wenig divergent nach hinten. Die Spirakularplatten sind breit oval oder subzirkular, die längere Achse quer 0,11 bis 0,13 mm lang, die andere 0,13 bis 0,16 mm. Die Coxen sind flach und ohne Dornen. Die Tarsi sind schlank und relativ lang, sie sind über den größten Teil ihrer Länge mit parallelen Seiten ausgestattet oder verjüngen sich allmählich. Der Tarsus I verjüngt sich hinter dem Haller`schen Organ zur Spitze hin. Die Länge des Tarsus I beträgt 0,44 bis 0,48 mm, die des Tarsus IV 0.44 bis 0,50 mm.
Larve: 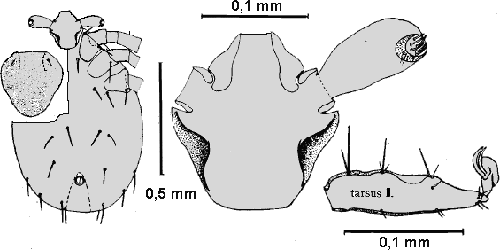 Der Körper ist länglich-oval, am breitesten etwa in der halben Länge. Die Farbe ist gelb-braun. Das Opisthosoma trägt lange Borstenhaare (Setae). Länge der vollgesogenen Larven 0,9 mm bei einer Breite von 0,62 mm. Die Zervikalfalten sind kurz, vorne stärker ausgebildet und laufen vor dem Erreichen der postero-lateralen Falten aus. Das Scutum ist etwas länger als breit, fein punktiert mit wenigen Borstenhaaren (Setae), seine Länge beträgt 0,3, seine Breite 0,28 mm. Die ⇒ Basis capituli ist breit, ihre Seitenränder kurz und gekrümmt. Die Basis capituli ist frei von ⇒ Cornua. Die Oberfläche der Basis capituli ist leicht ⇒ konvex gebogen, glatt, nicht gepunktet. Ventral ist sie leicht tailliert, mit konvergierenden Seiten zu einem gebogenen, hinteren Rand. Die ⇒ Palpen sind breiter als die der Nymphen, ihre Länge beträgt 0,12, ihre Breite 0,05 mm. Sie verlaufen außen seitlich gerade, innen gekrümmt. Die ⇒ Coxen sind flach, ohne Dornen aber mit langen Borsten versehen. Coxa I ist subtriangular geformt; Coxa II ist lang, an ihrer Innenfläche abgerundet; Coxa III ist wiederum subtriangular. Die Tarsen sind über den größten Teil ihrer Länge mit parallelen Seiten versehen. Der Tarsus I verjüngt sich jenseits des Haller`schen Organs bis zu seiner Spitze, er besitzt zudem dorsal eine wellige Oberfläche und ist 0,13 mm lang. Die Analfalte ist Spitzbogen-förmig.
Der Körper ist länglich-oval, am breitesten etwa in der halben Länge. Die Farbe ist gelb-braun. Das Opisthosoma trägt lange Borstenhaare (Setae). Länge der vollgesogenen Larven 0,9 mm bei einer Breite von 0,62 mm. Die Zervikalfalten sind kurz, vorne stärker ausgebildet und laufen vor dem Erreichen der postero-lateralen Falten aus. Das Scutum ist etwas länger als breit, fein punktiert mit wenigen Borstenhaaren (Setae), seine Länge beträgt 0,3, seine Breite 0,28 mm. Die ⇒ Basis capituli ist breit, ihre Seitenränder kurz und gekrümmt. Die Basis capituli ist frei von ⇒ Cornua. Die Oberfläche der Basis capituli ist leicht ⇒ konvex gebogen, glatt, nicht gepunktet. Ventral ist sie leicht tailliert, mit konvergierenden Seiten zu einem gebogenen, hinteren Rand. Die ⇒ Palpen sind breiter als die der Nymphen, ihre Länge beträgt 0,12, ihre Breite 0,05 mm. Sie verlaufen außen seitlich gerade, innen gekrümmt. Die ⇒ Coxen sind flach, ohne Dornen aber mit langen Borsten versehen. Coxa I ist subtriangular geformt; Coxa II ist lang, an ihrer Innenfläche abgerundet; Coxa III ist wiederum subtriangular. Die Tarsen sind über den größten Teil ihrer Länge mit parallelen Seiten versehen. Der Tarsus I verjüngt sich jenseits des Haller`schen Organs bis zu seiner Spitze, er besitzt zudem dorsal eine wellige Oberfläche und ist 0,13 mm lang. Die Analfalte ist Spitzbogen-förmig.
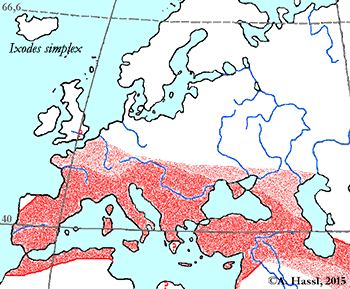 Verbreitung & Bionomie: Tiere der Art I. simplex sind selbst für Ixodes-Zecken ungewöhnlich unattraktive, kleine ⇒ Ektoparasiten. Sie wurden in Frankreich, der Schweiz, der ehemaligen CSSR, der Slowakei, Deutschland, Ungarn, Griechenland, Bulgarien, Rumänien, der Türkei, in Afrika, in Asien und Australien (cit. Barker et al. [2014]) nachgewiesen.
Verbreitung & Bionomie: Tiere der Art I. simplex sind selbst für Ixodes-Zecken ungewöhnlich unattraktive, kleine ⇒ Ektoparasiten. Sie wurden in Frankreich, der Schweiz, der ehemaligen CSSR, der Slowakei, Deutschland, Ungarn, Griechenland, Bulgarien, Rumänien, der Türkei, in Afrika, in Asien und Australien (cit. Barker et al. [2014]) nachgewiesen.
Die Lebensweise dieser Art ist meiner Meinung nach sehr schlecht dokumentiert. Die Ansicht dazu hängt von der Einstellung des Bearbeiters zum Spezialisierungsgrad der Art ab. Berichte zum Vorkommen werden danach gefertigt, ob es eine Alternative in der Artzuordnung gibt - wobei häufig nur die schiere Behauptung ohne Beleg dem Bericht zu Grunde liegt. Sollten sich zudem die Berichte über das vier Kontinente und mehr als die halbe Weltkugel umspannende, enorm große Verbreitungsgebiet dieser Zecken-Art als zutreffend herausstellen, so ist damit zu rechnen, dass es sich bei der heutigen Art I. simplex in Wahrheit um einen Artenkomplex handelt. Diese Ansicht äußerte bereits 1956 D. R. Arthur, cit. Arthur [1956], sie wurde aber damals nicht anerkannt. Molekularbiologische Untersuchungen zur Aufsplittung der Art wurden bislang auch nicht durchgeführt. Es ist allerdings sehr wahrscheinlich, dass sich die einzelnen Taxa innerhalb der heutigen Spezies nicht nur genetisch, sondern auch in ihrer Lebensweise unterscheiden.
Zur gegenwärtigen Situation in Europa ist festzustellen, dass diese Zecke wenig Charakteristika eines monophagen Spezialisten aufweist. Dies kann nun daran liegen, dass diese Zecken-Art erst vor stammesgeschichtlich sehr kurzer Zeit auf die Langflügelfledermaus als bevorzugten Wirt übergegangen ist, oder aber dass sie auf die - vielleicht erst kürzlich veränderte - Lebensweise der Wirte reagieren muss. Langflügelfledermäuse sind thermophile, wahrscheinlich mediterrane Tiere, sie leben also in Zentraleuropa am Rande ihres Verbreitungsgebietes. Vermutlich sind sie zudem zumindest im Mittelmeerraum ⇒ troglophil, sie leben also bevorzugt in natürlich entstandenen Felshöhlen. Außerdem sind sie sozial, sie leben in Kleingruppen, manchmal gemischt mit anderen Fledermausarten. I. simplex ist aber habituell eher schlecht an das Leben in einer Felshöhle angepasst. Dies gilt insbesondere dann, wenn sie ihren Wirt verlassen muss, um sich am oder im Untergrund zu häuten. Da es aber keinerlei Hinweis darauf gibt, dass es sich im Falle von I. simplex um eine zwei- oder gar ein-wirtige Zecken-Art handelt, erscheint es mir wahrscheinlicher, dass hier ein Fall einer sehr schlechten Dokumentation der Bionomie einer moderat ⇒ oligoxenen und (noch) wenig spezialisierten Zecken-Art vorliegt.
Als Gegenargument kann angeführt werden, dass diese Zecken-Art am Menschen und an anderen Wirbeltieren mit Ausnahme einiger weniger Fledermausarten als Blutspender völlig desinteressiert zu sein scheint. Dies spricht für einen hohen Grad an Spezialisierung. Über ihre Funktion als Vektor für Fledermaus-pathogene Erreger ist nichts bekannt. Eine geringe Bedeutung als Vektor wäre allerdings für einen blutsaugenden Wirtsspezialisten eine sehr ungewöhnliche Eigenheit. Allerdings könnte man diese Wissenslücke auch wiederum mit dem Desinteresse der Forschergemeinde an diesen unattraktiven Ektoparasiten erklären.
Wirte aller Stadien: Diese Zecken-Art ist streng wirtsspezifisch auf Unterordnungs-Niveau: Sie saugt nur an Fledermäusen, dh an Tieren der Unterordnung Microchiroptera. 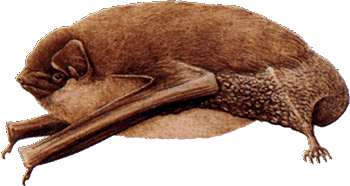 Ob sie allerdings „moderat wirtsspezifisch” ist, ist fraglich. Denn, sie nutzt klar einen Hauptwirt: Die Langflügelfledermaus, Miniopterus schreibersii. Möglicherweise sind die beiden anderen als Wirte notierten Fledermausarten, falls sie überhaupt richtig bestimmt wurden, Zufallsfunde. Dafür spricht, dass Langflügelfledermäuse intra- und auch interartlich gesellige Tiere sind. Es könnte sich also auch um eine homogen ⇒ polyxene Zecken-Art handeln.
Ob sie allerdings „moderat wirtsspezifisch” ist, ist fraglich. Denn, sie nutzt klar einen Hauptwirt: Die Langflügelfledermaus, Miniopterus schreibersii. Möglicherweise sind die beiden anderen als Wirte notierten Fledermausarten, falls sie überhaupt richtig bestimmt wurden, Zufallsfunde. Dafür spricht, dass Langflügelfledermäuse intra- und auch interartlich gesellige Tiere sind. Es könnte sich also auch um eine homogen ⇒ polyxene Zecken-Art handeln.
- Nachgewiesene Wirte:
- Chiroptera: Myotis myotis Borkhausen, 1797 dt: Großes Mausohr;
- Rhinolophus hipposideros (Bechstein, 1800) dt: Kleine Hufeisennase;
- Miniopterus schreibersii (Kuhl, 1817) dt: Langflügelfledermaus.
Erreger- und Vektorfunktion: Nicht bekannt.
Ixodes (Exopalpiger) trianguliceps Birula, 1895
dt: Mauszecke; en: marsh tick
Abb. VIII.5.71: Ixodes trianguliceps ♀.
© Malcolm Storey.
Synonyme:
I. tenuirostris Neumann, 1901;
I. nivalis Rondelli, 1928;
I. suecicus Schulze, 1930;
I. heroldi Schulze, 1939.
 Weibchen: Nüchtern haben sie eine Länge von 2,0 mm bis 2,4 mm, vollgesogene Weibchen können bis 8,0 mm lang sein. Das Scutum ist 0,8 mm lang, im hinteren Viertel am breitesten. Das Ende ist breit abgerundet. Die Scapulae sind stumpf. Zervikalfurchen fehlen, Lateralfurchen sind lang und laufen an der Schildkante entlang. Die Oberfläche ist glatt und mit nur wenigen Punkten. Auf der ⇒ Basis capituli sitzen kleine, nach hinten gerichtete ⇒ Cornua. Die Seitenränder der Basis capituli sind gewölbt und laufen zusammen. Die Palpentrochanter bilden eine breite ohrenförmige Platte mit einem spitz endenden Fortsatz, der bis zur Mitte des Hypostoms reicht. Die ⇒ Areae porosae sind groß und unregelmäßig. Die ⇒ Palpen sind dünn. Ihre Außenseite ist gerade, die Innenseite des zweiten Glieds ist gewölbt, die des dritten stark ausgehöhlt. Das Hypostom ist in Höhe des sechsten Seitenzahn am breitesten. Es endet stumpf. Es trägt neun Seitenzähne, welche stumpf und kaum größer als die Innenzähne sind. Auf dem Hypostom gibt es keine zahnfreie Fläche. Die Vorderseiten der ⇒ Coxen des ersten Beinpaares sind stark ⇒ konkav gekrümmt. Dornen sind nicht vorhanden. Die ⇒ Pulvilli erreichen in ihrer Längserstreckung die Spitzen der Krallen. Die ⇒ Genitalöffnung liegt zwischen den Coxen des dritten Beinpaares.
Weibchen: Nüchtern haben sie eine Länge von 2,0 mm bis 2,4 mm, vollgesogene Weibchen können bis 8,0 mm lang sein. Das Scutum ist 0,8 mm lang, im hinteren Viertel am breitesten. Das Ende ist breit abgerundet. Die Scapulae sind stumpf. Zervikalfurchen fehlen, Lateralfurchen sind lang und laufen an der Schildkante entlang. Die Oberfläche ist glatt und mit nur wenigen Punkten. Auf der ⇒ Basis capituli sitzen kleine, nach hinten gerichtete ⇒ Cornua. Die Seitenränder der Basis capituli sind gewölbt und laufen zusammen. Die Palpentrochanter bilden eine breite ohrenförmige Platte mit einem spitz endenden Fortsatz, der bis zur Mitte des Hypostoms reicht. Die ⇒ Areae porosae sind groß und unregelmäßig. Die ⇒ Palpen sind dünn. Ihre Außenseite ist gerade, die Innenseite des zweiten Glieds ist gewölbt, die des dritten stark ausgehöhlt. Das Hypostom ist in Höhe des sechsten Seitenzahn am breitesten. Es endet stumpf. Es trägt neun Seitenzähne, welche stumpf und kaum größer als die Innenzähne sind. Auf dem Hypostom gibt es keine zahnfreie Fläche. Die Vorderseiten der ⇒ Coxen des ersten Beinpaares sind stark ⇒ konkav gekrümmt. Dornen sind nicht vorhanden. Die ⇒ Pulvilli erreichen in ihrer Längserstreckung die Spitzen der Krallen. Die ⇒ Genitalöffnung liegt zwischen den Coxen des dritten Beinpaares.
Männchen: Die Männchen sind klein, etwa 1,8 - 2,2 mal 0,8 mm, oval und rötlichgelb. Das Schild ist glatt mit nur wenigen Punkten. Die ⇒ Basis capituli wird nach vorne breiter. Das Hypostom ist kurz und breit und trägt an der Spitze zwei Längsreihen mit je drei oder vier schuppenförmig angeordneten, stumpfen Zähnen oder ist fast ganz zahnlos. Die ⇒ Palpen sind kurz und keulenförmig, sie neigen sich vorne zusammen. Die ⇒ Genitalöffnung ist groß und liegt auf Höhe des zweiten Beinpaares. Die Vorderseite der ansonsten runden und großen Spirakularplatte wirkt als wäre sie gerade abgeschnitten worden. Der erste Tarsus ist schlank und stufenlos. Die Medianplatte hat eine fast quadratische Form.
 Nymphe: Nüchterne Nymphen sind oval. Ihr Scutum ist ungefähr so lang wie breit. Die größte Breite wird aber erst im hinteren Teil erreicht. Die Zervikalfurchen sind undeutlich. Die Lateralfurchen sind tief und erreichen den hinteren Schildrand. Die Spirakularplatten sind quer gestreckt. Die Seiten des Hypostoms sind parallel und tragen acht Seitenzähne.
Nymphe: Nüchterne Nymphen sind oval. Ihr Scutum ist ungefähr so lang wie breit. Die größte Breite wird aber erst im hinteren Teil erreicht. Die Zervikalfurchen sind undeutlich. Die Lateralfurchen sind tief und erreichen den hinteren Schildrand. Die Spirakularplatten sind quer gestreckt. Die Seiten des Hypostoms sind parallel und tragen acht Seitenzähne.
Larve: Der Körper ist eiförmig. Das Scutum ist breiter als es lang ist. Das ⇒ Capitulum gleicht dem der Nymphe. An den ⇒ Coxen des ersten und zweiten Beinpaares sitzt je ein kleiner Außen- wie Innendorn.
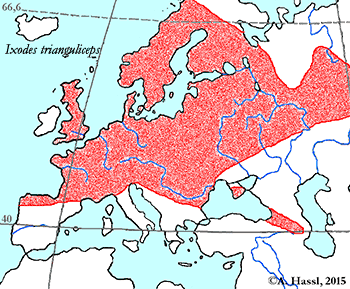 Verbreitung & Bionomie: I. trianguliceps ist eine sehr kleine Zecke, die beinahe ausschließlich die kühlen Regionen Europas besiedelt. Sie gilt als Zecke mit einer boreo-alpinen Verbreitung. Sie besiedelt Großbritannien, Irland, Frankreich, Nordspanien, Italien, Belgien, Holland, Deutschland, Dänemark, Norwegen, Schweden, Polen, Schweiz, Österreich und Russland. Diese Art ist die einzig bekannt gewordene Zecken-Art Europas, die tatsächlich dauerhaft in höheren Lagen der Alpen, bis 2400 m, und im hohen Norden, bis Narvik, leben kann. cit. Mahnert [1971]. Noch weiter nördlich, bis über das Nordkap, ist nur der ⇒ nidikole Seevogelspezialist I. uriae White, 1852 zu finden. Wahrscheinlich ist I. trianguliceps in kühlen, moderat feuchten, beschatteten Laub- und Mischwäldern verbreitet. Als Wirte wurden bisher fast nur kleine, frei-lebende Säugetiere, insbesondere Mäuse und Spitzmäuse ausgemacht. Der Status als oligophager Spezialist ist allerdings nicht gesichert. Sicherlich handelt es sich aber nicht um einen muridophilen Landwirtschaftsfolger. Mensch werden wahrscheinlich nicht befallen. Diese Art lebt in der Regel frei, möglicherweise aber immer nahe den Nestern oder Höhlen ihrer Wirte in Wäldern. Sie ist aber auch in unbewaldeten Höhenlagen und anderen baumlosen Gebieten gefunden worden, wobei keine Angaben über das Mikroklima der Fundstellen gemacht wurden. Vielleicht handelt es sich um einen Pirschjäger. In Österreich wurden Adulte im Mai und Juli, Nymphen und Larven von Mai bis November gefunden. Allerdings soll die saisonale Aktivität der Larven unimodal ausgeprägt sein, die der Nymphen und der Weibchen ⇒ bimodal. Die Larven zeigen die höchste Aktivität von Oktober bis Dezember oder aber ganzjährig (!), die Nymphen vom April bis September, und die Weibchen von März bis Mai oder aber beide Geschlechter vom April bis Oktober. cit. Walter [1981] und Nowak-Chmura et Siuda [2012].
Verbreitung & Bionomie: I. trianguliceps ist eine sehr kleine Zecke, die beinahe ausschließlich die kühlen Regionen Europas besiedelt. Sie gilt als Zecke mit einer boreo-alpinen Verbreitung. Sie besiedelt Großbritannien, Irland, Frankreich, Nordspanien, Italien, Belgien, Holland, Deutschland, Dänemark, Norwegen, Schweden, Polen, Schweiz, Österreich und Russland. Diese Art ist die einzig bekannt gewordene Zecken-Art Europas, die tatsächlich dauerhaft in höheren Lagen der Alpen, bis 2400 m, und im hohen Norden, bis Narvik, leben kann. cit. Mahnert [1971]. Noch weiter nördlich, bis über das Nordkap, ist nur der ⇒ nidikole Seevogelspezialist I. uriae White, 1852 zu finden. Wahrscheinlich ist I. trianguliceps in kühlen, moderat feuchten, beschatteten Laub- und Mischwäldern verbreitet. Als Wirte wurden bisher fast nur kleine, frei-lebende Säugetiere, insbesondere Mäuse und Spitzmäuse ausgemacht. Der Status als oligophager Spezialist ist allerdings nicht gesichert. Sicherlich handelt es sich aber nicht um einen muridophilen Landwirtschaftsfolger. Mensch werden wahrscheinlich nicht befallen. Diese Art lebt in der Regel frei, möglicherweise aber immer nahe den Nestern oder Höhlen ihrer Wirte in Wäldern. Sie ist aber auch in unbewaldeten Höhenlagen und anderen baumlosen Gebieten gefunden worden, wobei keine Angaben über das Mikroklima der Fundstellen gemacht wurden. Vielleicht handelt es sich um einen Pirschjäger. In Österreich wurden Adulte im Mai und Juli, Nymphen und Larven von Mai bis November gefunden. Allerdings soll die saisonale Aktivität der Larven unimodal ausgeprägt sein, die der Nymphen und der Weibchen ⇒ bimodal. Die Larven zeigen die höchste Aktivität von Oktober bis Dezember oder aber ganzjährig (!), die Nymphen vom April bis September, und die Weibchen von März bis Mai oder aber beide Geschlechter vom April bis Oktober. cit. Walter [1981] und Nowak-Chmura et Siuda [2012].
Wirte aller Stadien: Wahrscheinlich ausschließlich frei-lebende Mäuseartige, insbesondere Waldmäuse und Spitzmäuse. Für alle Zeckenstadien ist die Rötelmaus auf Grund ihrer hohen Populations- und Befallsdichte der wichtigste Wirt. Aus Belgien wurden Berichte des Befalls von Ratten bekannt.
- Heimische Wirte:
- Wirte ohne Stadienzuordnung:
- Rodentia: Rattus rattus (Linnaeus,1758) dt: Hausratte;
- Rattus norvegicus (Berkenhout, 1769) dt: Wanderratte.
- Wirte der Larven:
- Eulipotyphla: Talpa europaea Linnaeus, 1758 dt: Maulwurf;
- Sorex minutus Linnaeus, 1766 dt: Zwergspitzmaus;
- Sorex araneus Linnaeus, 1758 dt: Waldspitzmaus;
- Sorex alpinus Schinz 1837 dt: Alpenspitzmaus;
- Neomys fodiens (Pennant, 1771) dt: Wasserspitzmaus;
- Crocidura suaveolens (Pallas, 1811) dt: Gartenspitzmaus.
- Rodentia: Apodemius flavicollis (Melchior, 1834) dt: Gelbhalsmaus;
- Apodemus sylvaticus (Linnaeus, 1758) dt: Waldmaus;
- Myodes glareolus (Schreber, 1780) dt: Rötelmaus;
- Arvicola terrestris (Linnaeus, 1758) dt: Ostschermaus;
- Microtus subterraneus (Sélys-Longchamps, 1836) dt: Kurzohrmaus;
- Microtus agrestis (Linnaeus, 1761) dt: Erdmaus;
- Chionomys nivalis Martins, 1842 dt: Schneemaus.
- Wirte der Nymphen:
- Eulipotyphla: Talpa europaea Linnaeus, 1758 dt: Maulwurf;
- Sorex alpinus Schinz, 1837 dt: Alpenspitzmaus;
- Neomys fodiens (Pennant, 1771) dt: Wasserspitzmaus;
- Sorex minutus Linnaeus, 1766 dt: Zwergspitzmaus;
- Sorex araneus Linnaeus, 1758 dt: Waldspitzmaus;
- Crocidura suaveolens (Pallas, 1811) dt: Gartenspitzmaus.
- Rodentia: Apodemus flavicollis (Melchior, 1834) dt: Gelbhalsmaus;
- Apodemus sylvaticus (Linnaeus, 1758) dt: Waldmaus;
- Myodes glareolus (Schreber, 1780) dt: Rötelmaus;
- Arvicola terrestris (Linnaeus, 1758) dt: Ostschermaus;
- Microtus subterraneus (Sélys-Longchamps, 1836) dt: Kurzohrmaus;
- Microtus arvalis (Pallas, 1778) dt: Feldmaus;
- Microtus agrestis (Linnaeus, 1761) dt: Erdmaus;
- Chionomys nivalis Martins, 1842 dt: Schneemaus.
- Squamata: Zootoca vivipara (Lichtenstein, 1823) dt: Mooreidechse. cit. Nowak-Chmura et Siuda [2012].
- Wirte der Adulttiere:
- Rodentia: Apodemus flavicollis (Melchior, 1834) dt: Gelbhalsmaus;
- Apodemus sylvaticus (Linnaeus, 1758) dt: Waldmaus;
- Myodes glareolus (Schreber, 1780) dt: Rötelmaus;
- Microtus arvalis (Pallas, 1778) dt: Feldmaus.
Erregerfunktion: Nicht bekannt.
Vektorfunktion: I. trianguliceps fungiert als Hauptvektor von Frühsommer-Meningoenzephalitis (FSME) innerhalb der Kleinsäugerpopulationen und von Theileria microti (Franca, 1912), sowie als Nebenvektor für das Virus der Frühsommer-Meningoenzephalitis (FSME) in anderen Wirtspopulationen und ⇒ Biotopen. Diese Spezies ist ⇒ Überträger von Francisella tularensis (McCoy et Chapin, 1912), Coxiella burnetii (Derrick, 1939), Borrelia burgdorferi Johnson et al., 1984 emend. Baranton et al., 1992 und in England von Louping-ill Virus.
Ixodes (Eschatocephalus) vespertilionis Koch, 1844
en: long-legged bat tick
Abb. VIII.5.76: Ixodes vespertilionis ♂.
© unbekannt.
Kolenati [1839] beschreibt in blumigen Worten eine Fledermauszecke mit dem deutschen Namen „Kleine bleigraue Fleischzecke”, bei der es sich nur um Zecken der Art I. vespertilionis handeln kann: „Die Männchen weisslich-gelb oder gelb, die Weibchen lebend blaugrau, nach dem Tode rothbraun, die Füsse, Fühler und das nach rückwärts verengte, verkehrt-eiförmige, fast sechseckige Schildchen gelb, letzteres hinten dunkler, in der Grundsculptur feinwellig-nadelrissig und fein flachpunktirt , mit zwei Gruben am Vorderrande und zwei nach vorne zusammenlaufenden Längseindrücken , die Füsse so lang als der Körper, der Leib zwischen den Stigmen und dem hinteren Ende an den Seiten sehr flach und etwas verschmälert ausgeschweift, oben und unten mit zerstreuten Borsten besetzt, mit drei dunkleren Striemen nach hinten und jederseits einem äusseren nach vorne beim Männchen, mit gleichnamigen Falten beim Weibchen.”
An anderer Stelle, aber im gleichen Werk, beschreibt er allerdings eine: „Blaue langfüssige Fleischzecke”, bei der es sich wohl auch um I. vespertilionis handelte: „Länglich-oval, vorne allmählich verschmälert, in der Richtungslinie der zwei vorletzten Fusspaare am breitesten, hierauf seicht ausgeschweift und nicht verschmälert, hinten flach zugerundet, das Männchen gelbbraun oder gelb, das Weibchen lebend schon blaugrau, Fühler und Füsse braungelb, die Fiüsse fast noch einmal so lang als der Körper, an den Enden der Glieder nicht verdickt, die Vorderbeine etwas kürzer als die anderen, das gelbbraune länglichovale Schildchen von der halben Körperlänge, hinten stark, vorne wenig verschmälert, mit vielen Längsstreifen und zwei nach hinten etwas divergirenden Längsfurchen, der Körper an der Ober- und Unterseite zerstreut kurzborstig, die Borsten gegen den Körperrand dichter stehend, die Ober- und Unterseite des Weibchens, die Unterseite des Männchens jederseits mit zwei nach hinten verlaufenden Bogenfurchen, welche sich vorne an der ⇒ Genitalöffnung vereinigen, der After mit einer nach hinten offenen, geschweiften Bogenfurche.”
Es wird derzeit angenommen, dass es sich bei I. (Eschatocephalus) vespertilionis um eine Sammelart handelt. Eine Aufspaltung ist absehbar.
Synonyme:
I. flavipes Koch, 1844;
I. trogladytes Schmidt, 1853;
Eschatocephalus gracilipes Frauenfeld, 1853;
Sarconyssus flavipes Koch, k.A.;
I. kochi Kolenati, 1856;
Sarconyssus brevipes Kolenati, 1857;
Haemalastor gracilipes Kolenati, 1857;
Sarconyssus exaratus Kolenati, 1857;
Sarconyssus flavidus Kolenati, 1857;
Sarconyssus nodulipes Kolenati, 1857;
Sarconyssus kochi Kolenati, 1857;
Eschatocephalus seidlitzi Koch, 1872;
Eschatocephalus frauenfeldi Koch, 1872;
I. longipes Lucas, 1872;
I. siculifer Mégnin, 1880;
Haemalastor vespertilionis Neumann, 1899;
Eschatocephalus vespertilionis Neumann, 1901;
Eschatocephalus exaratus Neumann, 1901;
Eschatocephalus seidlitzi Neumann, 1901;
Eschatocephnlus flavipes Bonnet, 1908.
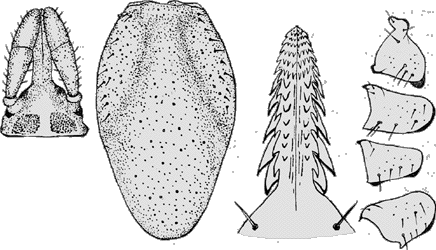 Weibchen: Hungrige Weibchen sind 3,5 bis vier mm lang und zwei mm breit. Die Beine sind spinnenartig lang und dünn. Die Tarsi sind sehr schmal. Die Tiere sind mit auffallend langen Borstenhaare (⇒ Setae) bedeckt. Das Scutum ist ungefähr in der Mitte am breitesten und ungefähr ein mm lang. Die Scapulae sind schwach und stumpf. Die hinteren Seitenränder des Scutums sind fast gerade und laufen nach hinten zusammen, so dass das Scutum in einer stumpfen Spitze endet. Auf dem Scutum sind vereinzelte Punkte. Borstenhaare (Setae) sitzen vor allem an den seitlichen Rändern. Die ⇒ Basis capituli ist frei von ⇒ Cornua. Die ⇒ Palpen sind keulenförmig und an der halbkugeligen Spitze am breitesten. Das ⇒ Hypostom endet in einer stumpfen Spitze. Am breitesten ist es in Höhe der dritten Seitenzähne (von unten). Es sind an jeder Seite acht Seitenzähne vorhanden. Seiten- und Innenzähne sind spitz. Die Spirakularplatte ist oval bis abgerundet rechteckig. Die Spirakularöffnung liegt in einem der schmalen Enden. Die Beincoxen haben keine Dornen. Sie sind glatt und mit langen Borstenhaaren). Die Kapsel des Haller`schen Organs ist offen. Die ⇒ Pulvilli sind klein.
Weibchen: Hungrige Weibchen sind 3,5 bis vier mm lang und zwei mm breit. Die Beine sind spinnenartig lang und dünn. Die Tarsi sind sehr schmal. Die Tiere sind mit auffallend langen Borstenhaare (⇒ Setae) bedeckt. Das Scutum ist ungefähr in der Mitte am breitesten und ungefähr ein mm lang. Die Scapulae sind schwach und stumpf. Die hinteren Seitenränder des Scutums sind fast gerade und laufen nach hinten zusammen, so dass das Scutum in einer stumpfen Spitze endet. Auf dem Scutum sind vereinzelte Punkte. Borstenhaare (Setae) sitzen vor allem an den seitlichen Rändern. Die ⇒ Basis capituli ist frei von ⇒ Cornua. Die ⇒ Palpen sind keulenförmig und an der halbkugeligen Spitze am breitesten. Das ⇒ Hypostom endet in einer stumpfen Spitze. Am breitesten ist es in Höhe der dritten Seitenzähne (von unten). Es sind an jeder Seite acht Seitenzähne vorhanden. Seiten- und Innenzähne sind spitz. Die Spirakularplatte ist oval bis abgerundet rechteckig. Die Spirakularöffnung liegt in einem der schmalen Enden. Die Beincoxen haben keine Dornen. Sie sind glatt und mit langen Borstenhaaren). Die Kapsel des Haller`schen Organs ist offen. Die ⇒ Pulvilli sind klein.
 Männchen:
Männchen: 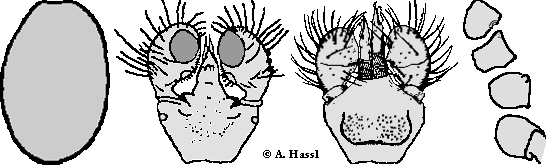 Das beinahe elliptische Scutum des Männchens ist nur schwach pigmentiert. Sein Rand ist deshalb im Leben schlecht zu erkennen, die Tiere scheinen „Schild-los” zu sein. Die Scapulae sind unauffällig und stumpf. An den zweiten und dritten ⇒ Coxen sitzen gering ausgebildete Außendornen. Das ⇒ Capitulum ist klein, ebenso sind die ⇒ Palpen klein, gedrungen, keulenförmig und mit sehr vielen Borstenhaaren (Setae) besetzt. Die Männchen dieser Zecken-Art besitzen allerdings kleine, aber deutlich ausgeprägte ⇒ Auriculae. Das Hypostom ist auch von ventral so schlecht erkennbar, dass es derzeit keine Beschreibung seines Aussehen gibt. Der Habitus des ⇒ Capitulums legt nahe, dass die Männchen dieser Art nicht Blut-saugen. Sie wurden auch noch nie beim Blutsaugen beobachtet. Allerdings gibt es auch eine Untersuchung zu ihrem Darminhalt, die zeigt, dass sie Blut im Darm haben können. Eine Ansicht ist, dass sie schnell und ohne dauerhafte Verbindung zum Wirt und an anderen Körperstellen als die Weibchen Blut saugen, nämlich nur an sehr dünnhäutigen Stellen. Offen bleibt, warum die habituell kräftigeren Weibchen an diesen Stellen nicht saugen. Eine andere, wohl bessere Interpretation dieses Befundes ist, dass es sich um Reste der Blutmahlzeit der Nymphe handelt.
Das beinahe elliptische Scutum des Männchens ist nur schwach pigmentiert. Sein Rand ist deshalb im Leben schlecht zu erkennen, die Tiere scheinen „Schild-los” zu sein. Die Scapulae sind unauffällig und stumpf. An den zweiten und dritten ⇒ Coxen sitzen gering ausgebildete Außendornen. Das ⇒ Capitulum ist klein, ebenso sind die ⇒ Palpen klein, gedrungen, keulenförmig und mit sehr vielen Borstenhaaren (Setae) besetzt. Die Männchen dieser Zecken-Art besitzen allerdings kleine, aber deutlich ausgeprägte ⇒ Auriculae. Das Hypostom ist auch von ventral so schlecht erkennbar, dass es derzeit keine Beschreibung seines Aussehen gibt. Der Habitus des ⇒ Capitulums legt nahe, dass die Männchen dieser Art nicht Blut-saugen. Sie wurden auch noch nie beim Blutsaugen beobachtet. Allerdings gibt es auch eine Untersuchung zu ihrem Darminhalt, die zeigt, dass sie Blut im Darm haben können. Eine Ansicht ist, dass sie schnell und ohne dauerhafte Verbindung zum Wirt und an anderen Körperstellen als die Weibchen Blut saugen, nämlich nur an sehr dünnhäutigen Stellen. Offen bleibt, warum die habituell kräftigeren Weibchen an diesen Stellen nicht saugen. Eine andere, wohl bessere Interpretation dieses Befundes ist, dass es sich um Reste der Blutmahlzeit der Nymphe handelt.
 Nymphe: Die ⇒ Palpen sind am Außenrand gerade, am Innenrand gewölbt. Das Hypostom verjüngt sich gleichmäßig zur Spitze hin. Auf jeder Seite sind acht Seitenzähne vorhanden. Die obersten liegen schuppenförmig übereinander, die Spitzen der folgenden drei sind leicht nach außen gebogen. Die Spitze des untersten Zahns ist stark einwärts gebogen. Die ⇒ Coxen und die Tarsen ähneln denen des Weibchens.
Nymphe: Die ⇒ Palpen sind am Außenrand gerade, am Innenrand gewölbt. Das Hypostom verjüngt sich gleichmäßig zur Spitze hin. Auf jeder Seite sind acht Seitenzähne vorhanden. Die obersten liegen schuppenförmig übereinander, die Spitzen der folgenden drei sind leicht nach außen gebogen. Die Spitze des untersten Zahns ist stark einwärts gebogen. Die ⇒ Coxen und die Tarsen ähneln denen des Weibchens.
Larve: Die Beschreibung der Larven ist sehr dürftig. Die ⇒ Palpen sind am Ende am breitesten. Die Nahtlinie zwischen zweiten und dritten Glied ist nicht zu erkennen. Das Hypostom ist kurz und breit. Man geht wohl davon aus, dass Schildzecken-Larven, die in Populationen von I. vespertilionis gefunden werden, nur dieser Art angehören können.
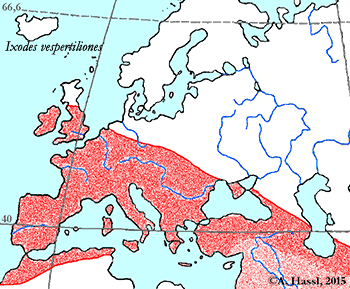 Verbreitung & Bionomie: Die Art kommt weltweit, mit Ausnahme der beiden Amerikas, überall dort vor, wo ihre Wirtstiere der Unterordnung Microchiroptera in Höhlen leben. Zumindest in Westfrankreich sind fast alle von Fledermäusen bewohnten Höhlen in einer geringen ⇒ Abundanz von dieser Zecken-Art bewohnt. Die Verbreitungslücken in Zentraleuropa sind wohl auf das Fehlen einer Suche nach der Art zurückzuführen. In Österreich ist die Art am Alpenostrand nicht selten, genaue Fundstellen werden allerdings aus Gründen des Höhlen- und Fledermausschutzes nicht genannt. Im Naturhistorischen Museum Wien liegen Belegexemplare aus Gresten in Niederösterreich und Aflenz in der Steiermark. Außerdem wurde diese Art in der Hermannshöhle/Niederösterreich gefunden. cit. Kolenati [1839].
Verbreitung & Bionomie: Die Art kommt weltweit, mit Ausnahme der beiden Amerikas, überall dort vor, wo ihre Wirtstiere der Unterordnung Microchiroptera in Höhlen leben. Zumindest in Westfrankreich sind fast alle von Fledermäusen bewohnten Höhlen in einer geringen ⇒ Abundanz von dieser Zecken-Art bewohnt. Die Verbreitungslücken in Zentraleuropa sind wohl auf das Fehlen einer Suche nach der Art zurückzuführen. In Österreich ist die Art am Alpenostrand nicht selten, genaue Fundstellen werden allerdings aus Gründen des Höhlen- und Fledermausschutzes nicht genannt. Im Naturhistorischen Museum Wien liegen Belegexemplare aus Gresten in Niederösterreich und Aflenz in der Steiermark. Außerdem wurde diese Art in der Hermannshöhle/Niederösterreich gefunden. cit. Kolenati [1839].
Zecken der Art I. vespertilionis sind attraktive, elegante Tiere mit einem an Weberknechte erinnernden Habitus. Sie sind moderat schnell beweglich und suchen aktiv nach ihren Wirtstieren. Als Teil der Höhlenfauna findet sie ihr dauerhaftes ⇒ Habitat in den dunkelsten Teilen einer Höhle, dort, wo die Luftfeuchte an die 100% beträgt. Ein Sinken der Luftfeuchte auf 61% führt zu einem Aktivitätsschub für wenige Stunden bis zum darauf folgenden Tod der Zecken. Alle Stadien leben in der Höhle, aber nicht dauerhaft auf den Wirtstieren, die sie nur zum Blutsaugen und angeblich auch zum Häuten und zum Eierlegen aufsuchen. cit. Obsomer et al. [2013]. Die Tiere sind aber nicht am Höhlenboden oder im Guano zu finden, sondern in den Felsspalten der Wände und der Decke.
Diese Zecken sind innerhalb der Unterordnung der Wirtstiere ⇒ euryxen, Wirtstiere sind ausschließlich Fledermäuse. Mutmaßlich handelt es sich um ein Element der Höhlenfauna. Dafür spricht auch, dass sie nachgewiesenerweise im Winter an den überwinternden Fledermäusen Blut saugen und ihre ganze Ontogenie an die Überwinterung ihrer Wirte angepasst haben. cit. Nowak-Chmura et Siuda [2012]. Eine andere Ansicht ist, dass die Zecken dieser Art das ganze Jahr hindurch aktiv sind und kavernikol sind. Denn sie sind offensichtlich an das Mikroklima der Höhlen bestens angepasst. cit. Hornok et al. [2014]. Zieht man diese These vor, dann könnten die Tiere - zumindest in bestimmten Teilen ihres Verbreitungsgebiets - sogar nur ⇒ troglophil sein. Denn am steirischen Alpenostrand, in Österreich, konnten Weibchen, Nymphen und Larven als festsitzende Blutsauger auf Fledermäusen auch im Sommer entdeckt werden. Zudem spricht das Wirtsspektrum, das viele nicht-höhlenbewohnende Fledermausarten umfasst, dafür. Diese Zecken-Art wurde außerdem In den Winterquartieren der Fledermäuse im Bodenmaterial nachgewiesen. Die Orte des Fangs der Fledermäuse waren Kirchtürme, Baumhöhlen, Feldhöhlen und Stollen. cit. Sixl et al. [1969]. Die Synthese dieser Ansichten wäre die Vermutung, dass sich unter der Artbezeichnung I. vespertilionis zumindest zwei Zecken-Arten verbergen, die sich in ihrer Lebensweise deutlich unterscheiden.
Die Tiere können bei passender Gelegenheit auch versuchen, Blut am Menschen zu saugen. cit. Piksa et al. [2013]. Allerdings gilt gemeinhinlich diese Zecken-Art als desinteressiert am Menschen.
Wirte aller Stadien: Diese Zecken-Art ist „moderat wirtsspezifisch”, dh sie ist streng wirtsspezifisch auf Unterordnungs-Niveau und gering wirtsspezifisch auf Art-Niveau: Sie saugt nur an Fledermäusen Blut, dh an Tieren der Unterordnung Microchiroptera; innerhalb dieser Unterordnung hat die Zecke aber ein breites Wirtsspektrum.
- Heimische Wirte:
- Chiroptera: Pipistrellus pipistrellus (Schreber, 1774) dt: Zwergfledermaus;
- Myotis myotis Borkhausen, 1797 dt: Großes Mausohr;
-
 Rhinolophus hipposideros (Bechstein, 1800) dt: Kleine Hufeisennase (Bild rechts).
Rhinolophus hipposideros (Bechstein, 1800) dt: Kleine Hufeisennase (Bild rechts). - In Österreich als Wirte nicht nachgewiesen:
- Plecotus auritus Linnaeus, 1758 dt: Braunes Langohr;
- Rhinolophus ferrumequinum (Schreber, 1774) Große Hufeisennase;
- Myotis daubentonii (Kuhl, 1817) dt: Wasserfledermaus;
- Myotis nattereri Kuhl, 1817 dt: Fransenfledermaus cit. Rupp et. al. [2004];
- Miniopterus schreibersii (Kuhl, 1817) dt: Langflügelfledermaus;
- Barbastella barbastellus (Schreber, 1774) dt: Westliche Mopsfledermaus.
Erregerfunktion: Nicht bekannt.
Vektorfunktion: I. vespertilionis kann das Virus der Frühsommer-Meningoenzephalitis (FSME) beherbergen. Die Bedeutung dieser Zecken-Art als Vektor oder ⇒ Reservoir ist allerdings nicht untersucht worden und daher auch nicht bekannt.
 Andreas R. Hassl
Andreas R. Hassl









