II.0 Des Zeckenwissens Essenz oder der Zecken Wesen
Auf dieser in den Fachbereich der Allgemeinen Zeckenkunde einführenden Internet-Seite wird ein gestraffter Überblick zum Wesen dieser Tiergruppe dargelegt und so soll das Wissenswerteste zur Lebensweise der Mitglieder dieser Tiergruppe in verschiedenen Lebensräumen allgemeinverständlich veranschaulicht werden. Unter dieser Thematik subsumiert sind Daten zu der Zecken Artenvielfalt, ihrem Lebenszyklus, ihrer Phylogenese und Herkunft, ihrer geographischen Verbreitung, zur Gefährdung dieser Tiergruppe und zur Geschichte ihrer Erforschung.
Inhaltsverzeichnis:
II.1 Erkennung & Unterscheidung
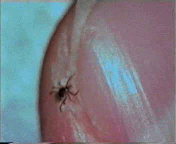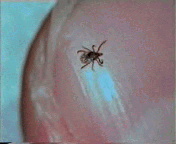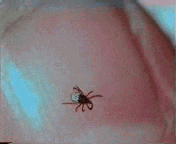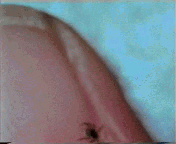
Abb. II.1: Der Charme einer Schildzecken-Nymphe: Eine Bewegungsstudie.
Aus einem von mir mitgestalteten Fernsehbeitrag (ORF Salzburg heute) eine kurze Sequenz, die die Bewegung einer Ixodes ricinus-Nymphe auf einem menschlichen Fingernagel zur Schau stellt. Die Sequenz wird in einer Endlosschleife gezeigt.
© A. Hassl.
Zecken sind eine Tiergruppe, die mit dem zoologischen Fachbegriff Ixodida bezeichnet wird. Es sind, relativ zu den anderen Vertretern, sehr große und ⇒ obligatorisch Blut-saugende Milben, also streng ⇒ stenophage Tiere. Sie sind sicherlich von allen Milbengruppen die am besten erforschte Gruppe, und auch diejenige, die, historisch gesehen, schon am längsten vom Menschen als Lästling wahrgenommen wird. Die Zeckenfauna der Welt besteht gegenwärtig aus 954 Arten, in ⇒ Zentraleuropa sind etwa 45 (2011: mehr als 42) Arten gefunden worden. In Österreich ist das Vorkommen von 30 Arten nachgewiesen oder zumindest sehr wahrscheinlich. Zecken unterscheiden sich von den anderen, „gemeinen” Milben durch den kumulativen Besitz eines zum Blutsaugapparat gestalteten Hypostoms, des Haller'schen Organs, des Gené'schen Organs, das möglicherweise das ⇒ autapomorphe Merkmal darstellt, eines Luftfeuchte absorbierenden Azinarsystems, das möglicherweise ebenfalls ein autapomorphes Merkmal ist (cit. Mans et al. [2016]), und fraglos auch durch ihre schiere Körpergröße. In Teilen cit. Frank [1976]. Die systematische Einordnung der Zecken wird ausführlich in einem eigenen Kapitel, der Systematik-Seite, dargelegt.
Die Zeckenfauna der Welt zerfällt in zwei große, medizinisch und ökonomisch bedeutende Gruppen, eine winzige, gegenwärtig noch (?) existierende reliktäre und eine bislang noch winzige, jedoch ausgestorbene Einheit: Die Schildzecken, die Lederzecken, die Nuttalliellidae und die Deinocrotonidae. Die beiden letzten Familien sind Einheiten ohne deutsche Trivialnamen, die jeweils nur eine einzige Art beherbergen. Eine Tabelle mit den wichtigsten biologischen Unterschieden zwischen Schild- und Lederzecken findet man im Systematik-Abschnitt des Textes. Die gemeinsamen und die sie unterscheidenden ⇒ morphologischen Eigenheiten sind im basalen Bestimmungsschlüssel gefasst. Das einfachste Unterscheidungsmerkmal der beiden großen Gruppen ist das namensgebende Merkmal: Schildzecken sind gut gepanzerte Tiere, sie tragen am Rücken ein hartes Schild, das ⇒ Scutum, das beinahe allen Lederzecken in beinahe allen Lebensstadien fehlt. Außerdem liegen der nymphalen und der adulten Lederzecken kleine Atemöffnungen (Spiracula) seitlich am Hinterkörper vor dem vierten Beinpaar, die großen Atemöffnungen der Schildzecken jedoch auf deren Bauchseite hinter dem vierten Beinpaar. Bei den Schildzecken-Weibchen und Nymphen erkennt ein aufmerksamer Beobachter die Teilbedeckung des Rückens mit dem dunklen Scutum leicht, bei den Männchen ist hingegen der ganze Rücken vom Scutum bedeckt und damit das Schild in vielen Fällen nicht einfach auszumachen. Den Lederzecken fehlt - bis auf wenige Ausnahmen - das harte, gut erkennbare Rückenschild, ihr Körper ist im nüchternen Zustand flach, die Oberfläche wirkt als wäre sie aus runzeligem Leder gemacht. In ⇒ Zentraleuropa gibt es allerdings nur wenige Lederzecken-Arten und die Tiere saugen meist an Vögeln Blut, weshalb diese Tiere wenig populär sind und häufig nicht als Zecken erkannt werden.
II.2 Die Geschichte der Zeckenkunde
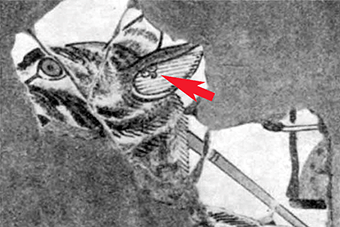
Abb. II.2: Drei Zecken (Pfeil) im Ohr einer Hyäne. Ca 1500 vChr, Ägypten.
Obgleich Zecken zweifelsfrei zu den allerersten Parasiten gehört haben, die Menschen als körperliche Quälgeister wahrgenommen haben und durch Entfernen bekämpften, sind die prähistorischen Zeugnisse einer Zeckenkunde dürftig. Arthur [1965] beschreibt die wohl bislang älteste Überlieferung eines Fundes von Zecken auf dem Ohr eines Hyänen-ähnlichen Tieres. Dabei handelt es sich um eine Malerei im Grab No. 155 des Antef, des großen Herolds des Königs, in Dra Abn el-Nago, West Theben aus der Zeit Hatschepsut-Thuthmosis III, etwa 1500 vChr. Die Diagnose „Zecken” basiert vor allem auf dem Erscheinungsbild und der Lokalisation der „Flecken” auf einem typischen Wirtstier, einem afrikanischen karnivoren Wildsäugetier, von dem bekannt ist, dass man zu dieser Zeit vergeblich versuchte, es zu domestizieren. Hingegen sind schriftliche Belege aus dieser Zeit bisher nicht bekannt geworden.
Einen eher kuriosen Fall von Ricinophagie (Essen von Zecken) erzählt eine Publikation aus den USA. Im Staate Arizona, in der Antelope Cave, wurde bei Ausgrabungen ein menschlicher ⇒ Koprolith geborgen, der zwischen 2028 vChr und 1100 nChr von einem Anasazi abgesetzt worden war. In ihm wurden die durchaus gut erhaltenen Überreste einer Zecke gefunden, die offensichtlich verspeist worden war. Es handelt sich um einen Vertreter der Gattung Dermacentor, vermutlich um ein Männchen. cit. Johnson et al. [2008].
Die Zecke als Ehrenbeleidigungstitel findet sich in der Ilias, verfasst von Homer, im 21. Gesang: Übersetzt man das altgriechische κυναμυια = kinamuia nicht mit der üblichen, aber sinnleeren „Hundsfliege” oder, erbärmlich, mit „erbärmliche Fliege”, sondern mit Zecke oder Hundezecke (= Zecke, die am dem Menschen am nächsten stehenden tierischen Begleiter und bedeutendsten Nutztier gefunden wurde), ergibt sich plötzlich Sinn in den Worten der Götter während der Götterschlacht:
Es führte . . .
392 Ares, der Schilddurchbrecher, und stürmte zuerst auf Pallas Athene,
393 haltend den ehernen Speer; und er rief die schmähenden Worte:
394 Warum treibst du die Götter zum Kampfe, du Zecke,
395 mit unersättlicher Frechheit. Dich trieb wohl großes Verlangen!
418 Aber als die lilienarmige Hera die Göttin (Aphrodite) erblickte;
419 sprach sie gleich zu Athene gewandt die geflügelten Worte:
420 Weh mir, unbezwungene Tochter des die Ägis erschütternden Zeus!
421 Schau, wie dreist die Zecke (= Aphrodite) den mordenden Ares hinwegführt
422 aus dem entscheidenden Kampf - durch den Aufruhr!
Auch in der Bibel, im 2. Buch Moses gibt es einen schwachen, schlecht zu argumentieren Hinweis auf Zecken und von Zecken übertragene Viehseuchen: In 2 Mose 16 wird der Erreger der vierten Plage - einer Ungezieferplage - manchmal mit „Hundsfliege” übersetzt, sonst mit dem allgemeinen Term „Ungeziefer”. Falls es sich dabei um Zecken gehandelt haben sollte, eine Annahme, gegen die aus naturwissenschaftlicher Sicht ein Gegenargument nicht existiert, so wird die zeitlich folgende, fünfte Plage - eine Viehseuche - zwanglos erklärbar: 2 Mose 9 beschreibt eine Nutztierseuche, die nur das mammale Weidevieh befällt. Dabei könnte es sich tatsächlich um die von Zecken übertragene Rinderbabesiose, hervorgerufen von Babesia divergens gehandelt haben. Der Einwand, dass die Bibel die betroffenen Tiere auflistet, diese aber wenig geeignete Wirte sind, lässt sich mit der Gegeneinrede der naturwissenschaftlichen Ungenauigkeit der Bibelstelle neutralisieren: Die aufgelisteten Dromedare waren zwar zur Zeit der Abfassung des 2. Buch Moses unter Pharao Necho II. (609-595 vChr) vielleicht in Ägypten schon domestiziert, ganz sicher aber nicht zur Zeit der sehr viel älteren Exodus-Tradition (ca 1310 vChr).
Eine handfeste Beschreibung von Zecken liefert dann Gaius Plinius Secundus Maior (23-79) in seiner Naturalis Historia (11:34 oder 39): „Est animal eius temporis, infixo semper sanguini capite vivens atque ita intumescens. unum animalium, cui cibi non sit exitus, dehiscit. in minia satietate, alimento ipso moriens. numquam hoc in iumentis gignitur, in bubus frequens, in canibus aliquando, in quibus omnia; in ovibus et in capris hoc solum.” Er berichtet also von der Zecke als einem schändlichen (REM: Charakterisierender Zusatz des Erst-Übersetzers auf Grund der Ilias-Stelle) Tier, das von Blut lebe, (festsitzt und anschwillt,) wobei es seinen Kopf ins Blut eingesenkt habe. Es sei das einzige unter den Tieren, welches keinen ⇒ Anus (Speisenausgang) hat: Es zerplatze bei Übersättigung und sterbe von seiner Nahrung. Dieses Tier fände sich nie auf Vieh (dh Esel, Pferd, Maulesel), es sei (hingegen) häufig auf Ochsen (Rindern?), zuweilen auch auf den (streunenden?) Hunden, auf denen alle Arten (von Ungeziefer) gefunden würden; auf Schafen und Ziegen fänden sich nur diese Tiere.
In Carl von Linnés „Systema Naturae” werden nur 31 Milbenarten beschrieben, die alle einer Gattung Acarus zugerechnet wurden. Da seine Sammlung verloren ging, konnten nur drei dieser Arten in die heutige Systematik eingegliedert werden. Große Fortschritte machte die Akarologie erst nach dem zweiten Weltkrieg, vor allem mit den hehren Zielen, die Krätze und die Räude menschliche und tierische Haut-Infektionen mit Milben auszurotten, und die Übertragungswege von bestimmten, durch Zecken übertragenen Krankheiten zu erforschen.
II.3 Die Ontogenie der Zecken
Die Lebensstadien
Abb. II.3: Die Lebensstadien von Schildzecken. Von links: Ei, Larve, Nymphe, zwei Adulttiere unterschiedlichen Geschlechts.
Milben durchlaufen gewöhnlich gut separierbare Entwicklungsstadien: Aus dem Ei schlüpft eine Larve. Diese unterscheidet sich markant von den darauffolgenden Stadien durch das Vorhandensein von nur drei Beinpaaren, und das, obwohl in der Embryonalphase vier Beinpaare angelegt werden. Nach dem Larvenstadium folgen ein oder mehrere Stadien als achtbeinige Nymphen, bis sich schließlich das geschlechtsreife = erwachsene = adulte Tier entwickelt. Die Nymphen ähneln im Habitus meist schon den Adulttieren, meist dem Weibchen. Bei den meisten Arten findet man zwei Geschlechter, Männchen und Weibchen, wobei bei den Ixodes-Arten der Trend zur Reduktion der Bedeutung der Männchen für die Fortpflanzung unübersehbar ist. Die Lebensstadien werden durch jeweils eine Häutung separiert. Es erfolgt dabei nicht nur ein Größenwachstum des Tieres, sondern auch, zumindest bei mehr-wirtigen Arten, ein Wechsel des Mikroökosystems. Die Häutungen sind auf die Sekretion von α-Ecdyson durch bisher unbekannte Zellen im subadulten Gehirn von Zecken zurückzuführen, nicht auf die Sekretion durch eine Prothoraxdrüse wie bei den Insekten. cit. Kaestner [1993]. Bei den Schildzecken ist eine erfolgreiche Blutaufnahme Voraussetzung und Signalgeber für eine Häutung.
Abb. II.4: Eine Schildzeckenlarve.
© Nosek et al. [1967 ].
Die Stammformen des Milbentaxon Actinotrichida sollen zwei frei-lebende Larvenstadien besessen haben: Eine Prälarve und eine Larve. Bei einigen Milbenarten und anderen Arachniden existiert diese Prälarve auch heute noch, sie ist einfach gebaut und nimmt keine Nahrung zu sich. In der Gruppe der Zecken ist dieses Prälarvenstadium heute nirgends mehr erkennbar, es gibt nur ein Larvenstadium. Als Beispiel für den typischen Habitus einer Schildzeckenlarve wird im Bild die Larve von Ixodes scapularis Say, 1821 dargestellt, man beachte insbesondere die Sechs-Beinigkeit. Die Larven der Schildzecken saugen regelmäßig Blut an einem Wirtstier. Schildzecken durchlaufen nur ein einziges Larven- und ein einziges Nymphenstadium. Sie beenden jedes ihrer präadulten Entwicklungsstadien durch eine Häutung, der eine Blutmahlzeit vorangeht. Die Adulttiere der Schildzecken suchen sich noch einmal einen Wirt auf und, häufig gleichzeitig, suchen sie sich einen Geschlechtspartner. Nach der Blutmahlzeit legen die Weibchen der Schildzecken meist viele Eier, manchmal mehrere Tausend. Diese Eier werden in der obersten Bodenschicht deponiert, das Weibchen sucht zum Eierlegen einen mikroklimatisch günstigen Platz auf. Unmittelbar nach der Eiablage verendet sie. Die Männchen sterben bereits kurz nach der Begattung, manche Schildzecken-Männchen saugen davor oder gleichzeitig noch Blut, andere, vermutlich höher entwickelte, benötigen hingegen eine Blutmahlzeit nicht mehr für ihre Existenz und können sich dennoch erfolgreich paaren.
Obgleich die Lehrmeinung ist, dass Lederzecken höher entwickelt sind als Schildzecken, erscheint zumindest die Individualentwicklung der Gattung Argas als Mosaik ursprünglicher und abgewandelter Merkmale: Bei einigen Lederzecken-Arten ist das erste Stadium nach dem Ei, das Larvenstadium, gar nicht aktiv und saugt auch nicht. Es verbleibt in der Eihülle und häutet sich dort zur ersten Nymphe, oder es verlässt die Eihülle, um sich unmittelbar danach zu häuten. Die Larven anderer Arten saugen hingegen Blut und suchen gezielt als Pirschjäger einen geeigneten Wirt. Die Larven der Hühnerzecke verbleiben jedoch am Wirt, wie oft sie dort Blut saugen, ist nicht bekannt. Es ist auch nicht ganz klar, ob diese Larven sich am Wirt zur Nymphe häuten oder diesen dazu verlassen müssen. Lederzecken durchlaufen gewöhnlich mehrere Nymphenstadien, bis zu sechs werden genannt. Jedenfalls benötigt die erste Nymphe aber immer zumindest eine Blutmahlzeit zum weiteren Überleben. Im Falle von Arten, die inaktive Larven besitzen, benötigt die Nymphe diese Mahlzeit vermutlich unmittelbar nach dem Schlupf aus dem Ei - sie kann also nicht auf das zufällige Auftauchen eines geeigneten Wirtes warten. Man vermutet, dass alle oder einige Nymphenstadien von Lederzecken auch mehrmals Blut saugen können, bevor sie sich erneut häuten. Die Adulttiere von Lederzecken saugen mehrmals Blut, und die Weibchen legen nach einer Blutmahlzeit jeweils nur wenige Eier ab. Die Eier werden nicht weiter gepflegt und im Regelfall auch nicht an für die Eientwicklung günstigen Orten deponiert. Entwicklungsbiologisch betrachtet, ersparen sich solche Arten den Wechsel des Mikroökosystems und das Problem der Missdimensionierung der larvalen Saugwerkzeuge gemessen an der Hautanatomie des bevorzugten Wirtes. Allerdings erinnert der Lebenszyklus der heimischen Argas-Arten sehr an das Raubmilben-Erbe und an die Situation bei den Krebstieren: Die Stadien saugen Blut, wenn sie als Pirschjäger und/oder Nestschmarotzer erfolgreich waren, und sie häuten sich, wenn sie zu groß werden. Fraglich ist für mich, ob dies eine Anpassung an das Leben in einer Vogelkolonie ist und damit ein abgeleitetes Merkmal darstellt, oder ob dies tatsächlich eine reliktäre Strategie der Ontogenie ist.
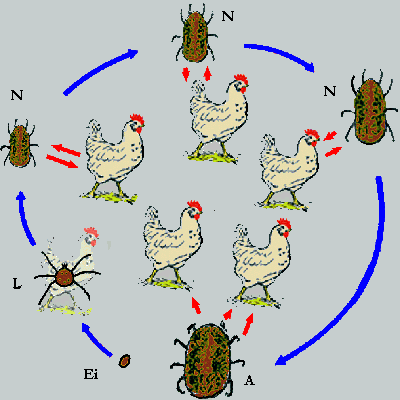
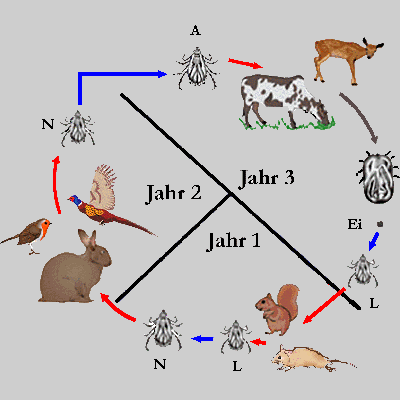
Abb. II.5: Die Ontogenie von Leder- und Schildzecken: Blaue Pfeile repräsentieren Häutungen, rote Pfeile die Aufsuche und das Verlassen eines Blutspenders. Die Lederzecken werden durch eine heimische Argas-Art vertreten, deren Larven Blut saugen und während ihres Daseins als Larve am Wirt verbleiben. Die Schildzecken werden durch eine drei-wirtige, drei-jährige und ⇒ telotropische Dermacentor-Art vertreten. L ... Larve; N ... Nymphe; A ... Adulttier. Das vollgesogene Weibchen verlässt immer den Wirt, um am Boden ihre Eier zu legen (grauer Pfeil).
© A. Hassl.
Die Lebensphasen
Eine bemerkenswerte Eigenheit der Zecken ist, dass bei allen Arten im Lauf- ebens parasitierende und nicht-parasitierende Lebensphasen abwechseln. Auch jene Arten, die ⇒ permanent auf einem Wirt verharren, die ein-wirtigen Arten, saugen nur in bestimmten Perioden ihres Lebens Blut. Wenn sie gerade nicht Blut saugen, kriechen sie auf der Körperoberfläche des Wirtes umher, oder sie sind im Eistadium, das sich auf oder in der obersten Bodenschicht befindet. Sieht man einmal von den niemals parasitischen Eistadien ab, so besitzen die meisten heimischen Zecken-Arten am Boden, im Detritus oder an Pflanzen krabbelnde, frei-lebende Phasen. Genau betrachtet hat sogar jedes einzelne Stadium der meisten zwei- und drei-wirtigen Arten eine frei-lebende Phase, nämlich dann, wenn dieses Stadium gerade nicht am Wirt sitzt. Zecken leben daher in zwei verschiedenen Welten, auf die unterschiedliche, die Evolution antreibende Faktoren wirken: Einerseits müssen sie wie jeder Bewohner eines Freiland-Habitats die mechanischen, chemischen und physikalischen Einflüsse ertragen und sich vor Fressfeinden und Krankheitserregern in Acht nehmen. Andererseits bleibt ihnen in der parasitären Phase die Auseinandersetzung mit den ⇒ Immunsystemen und den mechanischen Abwehrmaßnahmen der Wirte nicht erspart. Sie wechseln laufend zwischen diesen Welten, was eines enorm hohen energetischen Aufwandes bedarf. Es ist nicht klar, welche Faktoren diesen Tieren den vorgezeichneten Weg zum ⇒ permanenten (Endo-)Parasiten versperren. Eine Mutmaßung ist, dass dieses ⇒ Taxon niemals die Fähigkeit entwickelt hat, das Immunsystem eines Wirbeltierwirtes effektiv lahm zu legen. Dies könnte mit der Körpergröße und der chemischen Zusammensetzung der Körperoberfläche der Zecken zu tun haben. Bei dieser Mutmaßung bleibt allerdings nun wieder ungeklärt, warum eine Reduktion der Körpergröße auf die einer sonstigen parasitischen Milbe, zB einer Krätzmilbe, diesem Taxon nicht gelingt.
II.4 Phylogenie
Man nimmt an, dass sich die Tiere, die zur Klasse der Arachniden gehören, bereits im Äon Proterozoikum vor etwa 600 Mill Jahren aus einem gemeinsamen Vorfahren entwickelt haben. Bereits damals entstanden auch die meisten großen Ordnungen innerhalb der Klasse. Arachniden-Fossilien aus dieser Zeit hat man aber noch nicht gefunden, Fossilien anderer Arthropoden allerdings schon. Für die meisten Arachnidenordnungen gibt es Nachweise aus dem Oberen Pennsylvanium (=Oberkarbon), vor etwa 300 Mill Jahren. Dies könnte daran liegen, dass erst damals die Umweltbedingungen so waren, dass eine erhaltende Einbettung und Fossilisierung von Spinnentieren möglich wurde. Lediglich von den Skorpionen und den Milben gibt es ältere Fossilien. Reste einer Milbe, Protacarus crani Hirst, 1923, werden in das Mittlere Devon vor etwa 400 Mill Jahren datiert.
Aus dem Quartär und dem Tertiär, vor 66 Mill Jahren bis heute, finden sich ausreichend Fossilien der Milben-Unterordnung Anactinotrichida, zu der auch die Zecken gehören. Allerdings stammen die Zecken-Fossilien fast ausnahmslos nur von Schildzecken, weil deren Cuticula beständiger ist als jene der Lederzecken. Das historisch erste bekannt gewordene Fossil einer Ixodidae, Ixodes succineus Weidner, 1964, wurde im baltischen Bernstein konserviert. Dieser bildete sich im späten Eozän vor etwa 35 Mill Jahren. cit. Weidner [1964]. Dieses Tier wurde 2016 neu beschrieben und in das heute nur in Asien verbreiteten Subgenus Partipalpiger eingereiht, mit einer Ähnlichkeit zur heute lebenden Art Ixodes ovatus. cit. Dunlop et al. [2016]. Poinar et Buckley [2008] beschreiben Compluriscutula vetulum, eine Schildzecke aus den Kreide-zeitlichen, 99 Mill Jahre alten Schichten Myanmars und meinen, dass es damals bereits eine reiche Zeckenfauna gegeben haben muss. Auch aus diesen Schichten wurde Cornupalpatum burmanicum beschrieben und die einzige Art der 2017 neu errichteten Familie Deinocrotonidae, Deinocroton draculi. cit. Peñalver et al. [2017]. Diese Zecken scheinen an gefiederten, Nester-bewohnenden Dinosauriern Blut gesaugt zu haben. Die Ansicht der reichen Kreide-zeitlichen Zeckenfauna wird gestützt durch den Fund eines Exemplars einer mit Cornuapalpatum verwandten Art, Amblyomma birmitum, ebenfalls in Kreide-zeitlichen Burmesischen Bernstein eingebettet. cit. Chitimia-Dobler et al. [2017]. Mit der Art Haemaphysalis cretacea wurde erstmals ein Vertreter einer heute noch exitierenden, Vögel und Säugetiere parasitierenden Gattung in 99 Mill Jahre altem, Burmesischem Bernstein gefunden. cit. Chitimia-Dobler et al. [2018].
Von ganz anderer zoopaläontologischer Qualität ist allerdings der Fund von einem Körperrest der rezent existierenden Art Dermacentor marginatus Sulzer, 1786 bei Starunia, einer zum Fundzeitpunkt kuk österreichischen Stadt, die heute in der Ukraine liegt, aus dem Pleistozän (vor 2,5-0,01 Mill Jahren). cit. Schille [1916].
Als altes, heute veraltertes und mit wenig Fakten unterlegtes Konzept gilt, dass eine lang andauernde Evolution der Zecken angenommen wurde, in der, häufig auftretend, eine gleichzeitige Artbildung (Co-Speziation) von Zecken und den spezifischen Wirtstieren für wahrscheinlich gehalten wurde. cit. Hoogstraal et Aeschlimann [1982]. Gleichzeitig wird dem Taxon Ixodida ein sehr hohes, aber nicht genau bestimmtes Alter zugeschrieben. Folgt man diesem Konzept, so sollen sich die Tiere, die heute als Lederzecken bekannt sind, im späten Perm und in der Untertrias, also vor ca 250 Mill Jahren, auf das Parasitieren von nicht näher bestimmten, weichhäutigen Reptilien spezialisiert haben. Die ⇒ prostriaten Schildzecken, die Vorläufer der heutigen Ixodes-Arten, sind älter als die ⇒ metastriaten Schildzecken. Von diesen spezialisierte sich zuerst das Taxon Amblyommina auf das Blutsaugen an Reptilien - dies soll allerdings bereits im späten Perm geschehen sein. In der Oberkreide, vor 100 - 66 Mill Jahren, spezialisierte sich das Taxon Haemaphysalina auf Säugetiere als gewöhnliche Wirtstiere. Black et Piesman [1994] stellten an Hand einer Sequenzierungsanalyse der mitochondrialen 16S rDNS fest, dass die Amblyomminae und die Haemaphysalinae Schwestergruppen sind, dass die Gattung Ornithodoros nicht monophyletischen Ursprungs ist, und dass die Gattung Argas und alle Schildzecken (Ixodinae) eine monophyletische und ursprünglich an den ersten Vögeln blutsaugende Gruppe ist. Die Trennung der letzteren beiden Gruppen von den anderen erfolgte vor ca 140 Mill Jahren in der Unterkreide.Die Ausbreitung dieser beiden Taxa über weite Teile der Welt vollzog sich mit der Radiation der Vögel zwischen 100 und 50 Mill Jahren vor unserer Zeit. Die Unterscheidung von pro- und metastriaten Schildzecken wird in dieser Studie nicht näher thematisiert. Konsens ist allerdings, dass einige australisch und ozeanisch verbreitete Ixodes-Arten einen ursprünglichen Schildzeckentypus beibehalten zu haben scheinen.
Das Schildzecken-Evolutionszentrum
Zwei sich grundlegend unterscheidende Hypothesen werden vertreten:
Abb. II.6: Die Verteilung der Kontinente vor 420 Mill Jahren.
© A. Hassl.
Dobson et Barker [1999] schlugen vor, dass sich die (Schild-)Zecken in dem Teil von Gondwana entwickelten, der zum heutigen Australien wurde. Gemeint sind in dieser Publikation vermutlich wenig spezialisierte, ursprüngliche Arten von blutsaugenden Raubmilben, die alle kennzeichnenden Merkmale von Zecken (Ixodida) und einige der Merkmale von Schildzecken trugen. Die Entwicklung dieser Tiere zu den Formen, die wir heute Schildzecken nennen, erfolgte vor etwa 408 Mill Jahren im Devon. Die ursprünglichen Wirte dieser vermutlich bereits damals ⇒ obligatorisch blutsaugenden und landlebenden Milben waren die ersten landlebenden Wirbeltiere, die mittlerweile längst ausgestorbenen, krokodilähnlichen Amphibien, die Dachschädellurche. Diese These stellt Formen, die sich später zu Schildzecken entwickelten, an die Basis der Zecken-Phylogenie und impliziert damit die höhere Entwicklungsstufe und die Abgeleitetheit der Lederzecken. Sie lässt allerdings Raum für die heute populäre These einer Paraphylie der Lederzecken.
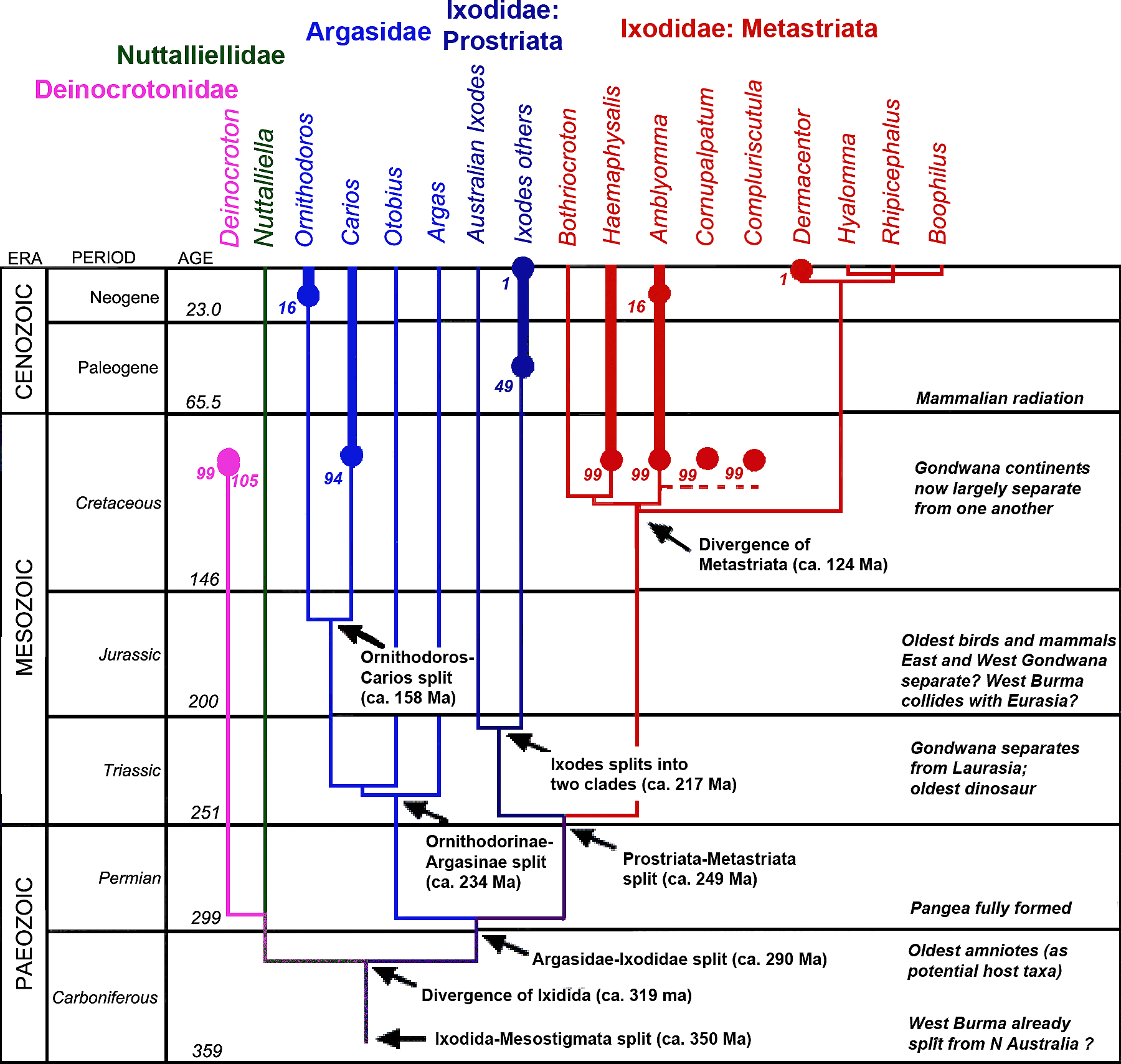
Abb. II.8: Ein phylogenetischer Stammbaum der Zecken, der überaus konservativ wirkt. Die dicken Linien repräsentieren das Auftreten von fossilen Formen, die Zahlen geben die bis heute verstrichene Zeit in Mill Jahren an. Das Original: © Chitimia-Dobler et al. [2009], verändert, um der Beschreibung der Deinocrotonidae und von Haemaphysalis cretacea gerecht zu werden. cit. Peñalver et al. [2017] und Chitimia-Dobler et al. [2018]. © A. Hassl.
Eine phylogenetische Analyse des gesamten mitochondrialen Genoms einiger Milbenarten aus dem Jahr 2009 differenziert diese These: Diese Analyse ergab folgende Zeiten der Entstehung einzelner Clades: Die Zecken (Ixodida) differenzierten sich als eigene Gruppe aus den anderen Parasitiformes zwischen dem späten Karbon und dem frühen Perm (300 ± 27 Mill Jahre), die Schwestergruppen Phytoseiidae und die Honigbienenmilben (Varroidae) trennten sich zwischen dem späten Perm und der frühen Trias (248 ± 29 Mill Jahre). Erdgeschichtlich wenig später existierten dann auch schon die Schildzecken, die Ixodidae (241 ± 28 Mill Jahre). Die Lederzecken (Argasidae) gibt es seit der späten Trias und der frühen Jura (214 ± 26 Mill Jahre). Die Entstehung der ⇒ prostriaten Schildzecken, diese beinhalten heute nur die Gattung Ixodes, kann man in die Zeit vor 196 ± 27 Mill Jahren legen. Hingegen lässt sich die Entstehung der ⇒ metastriaten Schildzecken, in Österreich alle anderen Schildzeckengattungen, erst später nachweisen, zwischen der späten Jura und der frühen Kreide (134 ± 22 Mill Jahren). cit. Jeyaprakash et Hoy [2009].
Abb. II.7: Die Verteilung der Kontinente vor 320 Mill Jahren.
© A. Hassl.
Eine Variante dieser Theorie ergibt sich aus der Mutmaßung, dass Nuttalliella namaqua eine Reliktart, ein lebendes Fossil, aus der Zeit vor der Trennung der Schild- und der Lederzecken ist. Folgt man dieser These, die von Mans et al. [2011] & [2012] vehement vertreten wird, so ist das Entwicklungsgebiet aller heute existierenden Zecken, gemeint sind wahrscheinlich die Schildzecken, die Karoo-Ebene in Südafrika. Die erdgeschichtliche Periode dieser Entwicklung war das Oberkarbon, heute das Subsystem Pennsylvanium, vor etwa 319 Mill Jahren. Im Pennsylvanium kollidierte der Südkontinent Gondwana mit dem Nordkontinent Laurussia. Dabei entstand entlang der Kollisions- ausgedehnter Faltengebirgsgürtel, dessen Überreste heute die Appalachen in Nordamerika und die Variszischen Massive, zB das südfranzösische Zentralmassiv, das Rheinische Schiefergebirge und die Böhmische Masse in Europa bilden. Diese Kollision war eine der letzten Phasen der Formierung des Superkontinents Pangaea. Der Sauerstoffanteil der Luft war zu dieser Zeit sehr hoch, er betrug ungefähr 35%. Dies ermöglichte ein Riesenwachstum von Insekten und eine starke Differenzierung der Gliedertiere. Terrestrisch, in den ausgedehnten sumpfigen Steinkohlewäldern, lebten ursprüngliche Tetrapoden, also vor allem Amphibien und die ersten Tiere, die man früher unter dem klassischen ⇒ Taxon „Reptilia”, heute unter dem als ⇒ Klade definierten Taxon Amniota subsumiert. Im Unterperm, vor 290 Mill Jahren, erreichte der Superkontinent Pangaea seine größte Ausdehnung mit einer Fläche von ca 138 Mill km2. Mit diesem Modell lässt sich die flächendeckende Ausbreitung beider großen Zeckenfamilien und das Vorkommen von Nuttalliella namaqua als Reliktart problemlos erklären. Die Ausbreitung der Schildzecken steht dann im Zusammenhang mit einer ersten großen Radiation der Tiergruppen, die die Amniota bilden. Dies sind die die Schuppenechsen, die Schildkröten, die Krokodile, die Vögel und die Säugetiere, und die Zeit der Radiation dieser Tiergruppe ist vor ca 100 Mill Jahren.
Vor einer neuen Situation steht man seit 2017, als eine Schwesterfamilie zu den Nuttallielliden beschrieben wurde, die ebenfalls bis jetzt monotypisch ist: Die Deinocrotonidae. In der Erstbeschreibung der nur fossil überlieferten einzigen Art der Familie, Deinocroton draculi, wird von einer Trennung von den Nuttalliiden gleichzeitig mit der Trennung von Schild- und Lederzecken vor circa 320 Millionen Jahren ausgegangen. cit. Peñalver et al. [2017]. Unerklärlich bleibt dabei aber die Seltenheit von Fossilien und Reliktformen der beiden kleinen Zecken-Familien.
Abb. II.9: Die Verteilung der Kontinente vor 146 Mill Jahren.
© A. Hassl.
Eine etwas andere These wird von Klompen et al. [1996] & [2000] vertreten. Sie besagt, dass sich die Schildzecken erst viel später, in der Kreide vor etwa 146 Mill Jahren, im heutigen Australien entwickelten. Damals war Pangaea längst zerfallen, Australien und die Antarktis hatten sich von den anderen Landmassen Gondwanas bereits getrennt. Damals gab es bereits eine reiche Fauna an Säugerartigen (Mammaliaforme), die aus heute beinahe gänzlich ausgestorbenen Gruppen von kleinen, meist bodenbewohnenden und bepelzten Tieren bestand. Die Kloakentiere (Monotremata) Australiens sind die Reste dieser Fauna. Der Ansatzpunkt dieser These ist die Publikation von Black & Piesman [1994] (siehe oben). Es ist die Feststellung, dass in der Gruppe der Schildzecken die Arten der Gattung Ixodes, und darunter insbesondere einige australische und ozeanisch verbreitete Arten, den ursprünglichen Schildzeckentypus beibehalten haben sollen. Bei diesen sind die Palpenglieder weniger verwachsen und die Bauchseite zeigt eine deutliche Aufteilung in isolierte Platten, während bei fortschrittlicheren Arten die Bauchplatten zurückgebildet sind. Es ist für mich aber unklar, ob diese ursprünglichen Ixodes-Arten tatsächlich Relikte der Ur-Ixodes-Fauna sind oder ob diese Merkmale bloße Anpassungen an die - selbst reliktäre - Kloakentier-Fauna des Lebensraums sind. Das Schicksal der Lederzecken wird in diesen Publikationen nicht thematisiert. Es lässt sich auch nicht erkennen, ob die Zeckenfamilien nach dieser These jeweils als monophyletische Gruppen angenommen werden.
Als etwas ketzerisch anmutende Alternativthese kann vorgebracht werden, dass eine mehrfache Entwicklung der Schildzecken auf verschiedenen Kontinenten und zu unterschiedlichen Zeitpunkten möglich wäre. Als ein Argument für diese These kann man die deutliche Kluft zwischen den pro- und den ⇒ metastriaten Schildzecken vorbringen. Diese Annahme zerstört allerdings das Lehrkanzel-Postulat einer ⇒ Monophylie der Schildzecken - weshalb diese These ungern diskutiert wird. Und Nuttalliella namaqua und vermutlich auch Deinocroton draculi zu fehlentwickelten Kuriositäten der Evolution, einem zufällig aufgetretenen Hybrid und/oder einem "missing link" machen.
Nicht ganz klar erkennbar ist, ob sich diese zwei oder drei Thesen im Grundsatz widersprechen oder ob sich eine Synthese bilden lässt. Sollten sich die Schildzecken tatsächlich in Australien entwickelt haben, müssen sie sich noch vor der Zeit des Aussterbens der Dinosaurier aus Australien heraus über die ganze Welt verteilt haben. Damit postuliert man Vögel bzw deren Vorläufer und flugfähige Dinosaurier als primäre Wirtstiere von den heute noch existierenden Schildzecken-Taxa. Die Klompen'sche Theorie unterscheidet sich von der von Dobson & Barker beim ersten Hinsehen vor allem im Zeitpunkt der Entstehung der Zeckenfamilien. Im Fall der Richtigkeit der Theorie Dobson & Barker's war Gondwana noch intakt, so dass die Vorläufer aller Zecken noch in die späteren Kontinente Australien, Antarktis, Südamerika, Afrika und Indien ohne Hilfe von (fliegenden) ⇒ Vektoren einwandern konnten. Somit konnten sich die beiden großen Zeckenfamilien zu einer beliebigen späteren Zeit trennen, falls man von einer ⇒ Monophylie der Lederzecken ausgeht. Vor 120 Mill Jahren hingegen stand Australien zwar noch in Verbindung mit der Antarktis, aber nicht mehr mit Südamerika, Afrika und Indien. Die Zecken müssen nach Klompen die Meere zwischen den Kontinenten mit Hilfe fliegender Vektoren überwunden haben. Diese Vektoren müssen wohl Flugsaurier gewesen sein, da zweifelhaft ist, ob die frühen Vögel weite Meeresstrecken überfliegen konnten. Dies erscheint zwar im Lichte des heutigen Vogelzuges und seiner Bedeutung bei der Verschleppung von Zecken kein problematisches Argument zu sein. Genauer betrachtet bedeutet die Klompen'sche Theorie aber, dass sowohl die Schild- wie auch die Lederzecken-Taxa, die außerhalb Australiens vorkommen, ein tagelanges Blutsaugen auf einem speziellen Wirt innerhalb einer engen Biozönose als gemeinsames, ursprüngliches Merkmal (= synapomorphes Merkmal) besitzen. Ein Argument für die Annahme, dass sich Schildzecken nur in dem Teil von Gondwana, der später Australien wurde, entwickelten, ist, dass das mutmaßliche Schwestertaxon der Zecken, die Ordnung Holothyrida, sich erst nach ihrer Entstehung im Laufe der letzten 100 Mill Jahre über Australien, Neuseeland, Süd- und Zentralamerika, auf Inseln der Karibik und des Indischen Ozeans ausgebreitet haben. Die gegenwärtig existierende primitivste Familie von holothyriden Milben, die Allothyridae, sind allerdings bis heute auf Australien und Neuseeland beschränkt. Eine Synthese der beiden Ansichten zur Zeckenevolution erscheint schwierig. Das Kernproblem ist die Stellung der Lederzecken: Nach der Lehrmeinung handelt es sich dabei um höher entwickelte Tiere als es Schildzecken sind. Eine mehrmalige Entstehung dieser Gruppe, der umweltbedingte Verlust des Schildes und andere ⇒ morphologische Modifikationen, sowie die Existenz der Nuttallielliden und der Deinocrotonidae sind aber mit einer relativ jungen Spezialisierung viel leichter zu erklären als mit bekannten Evolutionsmechanismen unter der Annahme einer Jahrhundertmillionen-langen, syntopen (= am Ort, im gleichen Biotop) Parallelentwicklung der Taxa.
Eine Hypothese zum Ursprung des ehemalig gültigen Taxon Carios, das heute in Teilen als Antricola eine eigene Lederzecken-Gattung sowie eine Untergattung innerhalb der vermutlich nicht monophyletischen Gattung Ornithodoros bildet, wies auf einen Ursprung in der Neotropischen Region, vermutlich nach der Isolierung von Südamerika vor rund 100 Mill Jahren, hin. Das Vorhandensein von Carios jerseyi, heute Ornithodoros jerseyi (Klompen et Grimaldi, 2001) in Nordamerika vor 90 bis 94 Mill Jahren ist mit dieser Hypothese kompatibel, wenn man eine Ausbreitung des Taxons über die Ozeanbarriere zwischen den Nord- und Südamerikanischen Landmassen für möglich erachtet. Die meisten rezenten Arten von Carios sind Säugetierparasiten, insbesondere Fledermäuse (Chiroptera) sind häufige Wirte von Cariosarten. Es ist evident, dass mit Hilfe dieser Wirtstiere die Zecken leicht über das Wasser zu transportieren sind. Allerdings stammen die frühesten Fossilien von Fledermäusen aus dem frühen Eozän, vor 55 Mill Jahren, und die Gruppe entstand wahrscheinlich in der obersten Kreidezeit, vor 65-70 Mill Jahre. Dies lässt die beiden zeitgenössischen Hauptgruppen der fliegenden Archosaurier, Vögel und Flugsaurier, als wahrscheinlichere Wirte von C. jerseyi erscheinen. Da heute viele Ornithodo- 3;Arten an Vögeln parasitieren, wird von einer weltweiten Verbreitung dieser Zecken durch Vögel ausgegangen. cit. Klompen et Grimaldi [2001].
Die Evolution des Blutsaugens
Um über Erdzeitalter hinweg als Blutsauger überleben zu können, muss der Parasit mit dem Blut und dem ⇒ Immunsystem des Wirtes koevoluieren. Mans, Louw et Neitz [2002] verglichen die Sequenzen von Hemmstoffen der Blutungsregulation und der Thrombozytenaggregation von Schild-, Lederzecken und blutsaugenden Insekten. Die Stoffe zur Hemmung der Blutgerinnung von Schild- und Lederzecken besitzen kaum Gemeinsamkeiten, ausgenommen ihre Funktion. Dies wird als Beleg für eine unabhängige Evolution des Blutsaugens innerhalb der Gruppen der Schild- und Lederzecken interpretiert. Leider fehlt in dieser Studie die Untersuchung der analogen Stoffe von Nuttalliella namaqua. Diese Untersuchung könnte helfen, die Stellung der Nuttallielliden gegenüber den beiden anderen Gruppen endgültig zu klären.
II.5 Habitate
Zecken bewohnen alle Arten von terrestrischen Habitaten, von den Tropen bis nördlich des Polarkreises, vom - and bis zum Rand des Gebirgsgletschers, von Feuchtgebieten bis zu Halbwüsten und Wüstenoasen. Sie haben von allen ⇒ t- l;ren, blutsaugenden Arthropoden das breiteste Lebensraumspektrum. In den Tropen, insbesondere in den Gebieten mit hoher Luftfeuchte, ist das Artenspektrum reicher als in trockeneren Arealen der gemäßigten Zonen. Dafür erhöht sich die ⇒ Abundanz der Individuen, die einer Art angehören, in den geeigneten Lebensräumen in unseren Breiten erheblich gegenüber tropischen Habitaten. In Österreich können im Buschland von Talniederungen über 100 Individuen von Ixodes ricinus pro 100 m2; gesammelt werden. Allerdings sind solche Angaben nur mit großer Vorsicht als Darlegungen der Häufigkeit zu interpretieren, werden doch üblicherweise Zecken aus dem Freiland mit Hilfe der Zeckenfahne entnommen. Aber nur lauerjagende Zecken reagieren auf diesen Köder, andere Zecken - inaktive oder anders jagende - werden so gar nicht erfasst. Tauben- und Hühnerzecken neigen in Schlägen und Geflügelställen zur Massenvermehrung mit vielen Tausend Exemplaren auf wenigen Quadratmetern Bodenfläche. Argasiden sind allerdings generell etwas wärmebedürftiger als Schildzecken.
Die mikroklimatischen Bedingungen der Habitate im Freiland üben einen bedeutenden Einfluss auf den Mikrolebensraum der Zecken aus. Viele Arten neigen daher zur Bildung von Inselvorkommen innerhalb ihres Verbreitungsgebietes. Ein bekanntes Beispiel ist das mosaikartige Auftreten von Holzböcken in den Gebieten in Österreich, die als zeckenverseucht angesehen werde- an sich beim Picknick am Waldesrand - Zeit ein Dutzend Zecken zuziehen, findet - em angrenzenden Feld über viele dutzende Meter keine einzige Zecke.
II.6 Wirtstiere
Ursprüngliche Wirte
Abb. II.10: Eine Darstellung eines Labyrinthodonten.
© A. Hassl.
Die ältesten Fossilien von Zecken stammen aus der Kreidezeit, zudem gibt es Fossilien aus dem Miozän, dem Oligozän und dem Eozän. Die ursprünglichen Wirte finden sich logischerweise in der Fauna der Entstehungszeit der Zecken, die allerdings eben, wie oben dargelegt, stark umstritten ist. Hoogstraal [1978] meinte, die ersten Wirte seien Reptilien gewesen, Oliver [1989] schlug Amphibien vor, Stothard et Fuerst [1995] Vögel, Dobson et Barker [1999] argumentierten für die labyrinthodonten Amphibien, die Dachschädellurche. Die Dachschädellurche, Labyrinthodontia oder Stegocephalia, sind eine Gruppe ausgestorbener ursprünglicher Landwirbeltiere (Tetrapoda), die vom späten Devon, vor ca. 400 Mill Jahren, bis in die frühe Kreide vor ca. 120 Mill Jahren existierte und weltweit verbreitet war. Das am häufigsten geäußerte Gegenargument ist jedoch, dass Dachschädellurche aquatische Tiere waren und die meisten heute existierenden Zecken einen submersen Aufenthalt nur wenige Stunden vertragen. Dieses Argument basiert jedoch auf der Annahme, dass ein viele Stunden lang andauerndes Blutsaugen ein ursprüngliches Merkmal der Zecken ist - was ich nicht glaube.
Rezente Wirte
Die meisten heute in Europa beheimateten Schildzecken-Arten sind relativ wenig wählerisch bei der Wirtsauswahl. Dies liegt vermutlich daran, dass sie im Wesentlichen nur das Hämoglobin, das Albumin, Globuline und Cholesterin zu ihrer Ernährung benötigen, Substanzen, die im Blut aller Wirbeltiere enthalten sind. Während die Schildzecken im Laufe ihrer Individualentwicklung ihren Wirt nie, ein- oder höchstens zweimal wechseln (ein-, zwei- oder drei-wirtige Arten), dafür aber der Saugakt mehrere Tage bis mehrere Monate dauern kann, wechseln die Lederzecken ihre Wirte mehrmals, verhalten sich häufig relativ wirtspezifisch, saugen dafür aber nur wenige Minuten bis höchstens ein paar Stunden lang Blut. Auf Grund dieser Präferenz neigen sie also zu Massenvorkommen in ⇒ Habitaten, die von einer großen Anzahl von Wirtstieren aus wenigen geeigneten Wirtstierspezies besiedelt sind. Evolutionär gesehen ist eine Monoxenie eine Sackgasse: Wie jede Spezialisierung führt sie zuerst zu hochgradig angepasstem Verhalten und Organreduktion, erhöht also die Effizienz der Existenz. Beim unausweichlichen Aussterben der Wirtstiere, beim Erlöschen der Wirtstier-Art, stirbt der ⇒ monoxene Parasit (meist) mit aus.
Ein bemerkenswertes Phänomen ist die Eigenheit bestimmter Schildzecken-Arten, während ihrer Ontogenie Tiergruppen als Wirte aufzusuchen, die ein ganz unterschiedliches Migrationsverhalten aufweisen. Bei solchen Arten ist meist die Nymphe, manchmal auch die Larve auf bodenlebende Kleinvögel spezialisiert, die Adulten auf große Säugetiere. Diese Lebensweise wird unter Experten ⇒ telotropisch genannt. Verharren die Zecken auch noch mehrere Tage lang am Wirt um ihn letztendlich doch immer zu verlassen, kann sich ein extrem komplexer Mechanismus zur Verteilung der Parasiten im Raum und in der Zeit ergeben.
II.7 Arealkunde
Die gegenwärtigen, häufig auch nur rezent gedeuteten Verbreitungsareale von heimischen Zecken sind keine Produkte des Zufalls, sondern das Ergebnis eines Zusammenspiels biotischer und abiotischer Faktoren in den ⇒ Biotopen und einer historischen Entwicklung. Zecken unterliegen jedoch nicht den sonst von ⇒ Ökologen genannten, die Verbreitung einer Art limitierenden Faktoren. So spielt zB die Bodenfeuchte in einigen Zentimetern Tiefe für sie eine enorme Rolle - für eine Tagschmetterlingsart wird dieser Faktor jedoch kaum limitierend für den Bestand sein. Das Verbreitungsareal einer Zecken-Art wird von ihrer ⇒ Tenazität bestimmt. Anders gesagt bedeutet das, eine Zecken-Art ist in einem Biotop dann vertreten, wenn genügend Mikrohabitate vorhanden sind, damit auf Ebene der Individuen die Tiere gerade noch überleben und sich fortpflanzen können. Diese Mikrohabitate werden durch vielfältige Einflüsse geprägt, die wechselwirken, ineinander greifen und sich nur gedanklich in Einzelphänomene zerlegen lassen. Eine Veränderung der Physiologie der Zecken-Art einerseit- ererseits eine Veränderung des Typus einer Stätte führen zum Entstehen neuer, für die Art geeigneter Lebensräume oder zum Erlöschen solcher. Durch Migration mittels arttypischer Ausbreitungsmechanismen werden die Verbreitungsareale ausgeweitet, oder aber die Art verschwindet an einem bestimmten Standort. Die wesentlichen Einflüsse auf die Verbreitung einzelner Zecken-Arten werden folgend genannt. Besonders interessant sind jene Fälle, in denen räumlich getrennt unterschiedliche Faktoren das Verbreitungsareal begrenzen, also zB im Norden die zu niederen Winterdurchschnittstemperaturen und im Süden eine prädatorische Unterlegenheit.
Evolutionäre Einflüsse
Die evolutionäre Begründung eines Verbreitungsareals legt das besondere Gewicht auf die paläogeographischen Veränderungen, in unserem Falle auf das Zusammenspiel von eiszeitlichen Refugialräumen und post-Pleistozäner Kolonisierung. Vermutlich alle heute in ⇒ Zentraleuropa verbreiteten und voreiszeitlich entstandenen Zecken-Arten haben die letzte Eiszeit in klimatisch begünstigten Refugien überdauert und breiten sich nun seit 10 000 Jahren wieder aus. Obligatorisch parasitische Arten wie zB Zecken benötigen allerdings immer einen Wirt - ihre Ausbreitung widerspiegelt also weit mehr die ⇒ postglaziale Ausbreitung der Wirte als eine eigenständige Kolonisation. Eingebettet in dieses Modell sind die Migrationsmechanismen: Insbesondere die lange blutsaugenden Schildzecken haben mit der Potenz zur phoretischen Verschleppung eine sehr effiziente Methode entwickelt um auch über weite Distanzen verschleppt zu werden. Zu den evolutionären Einflüssen gehört auch das Phänomen des Wirtswechsels - wegen der Strittigkeit der Signifikanz der Wirtsspezifität im Rahmen einer Unterscheidung der Arten wird dieser Einfluss kaum je thematisiert.
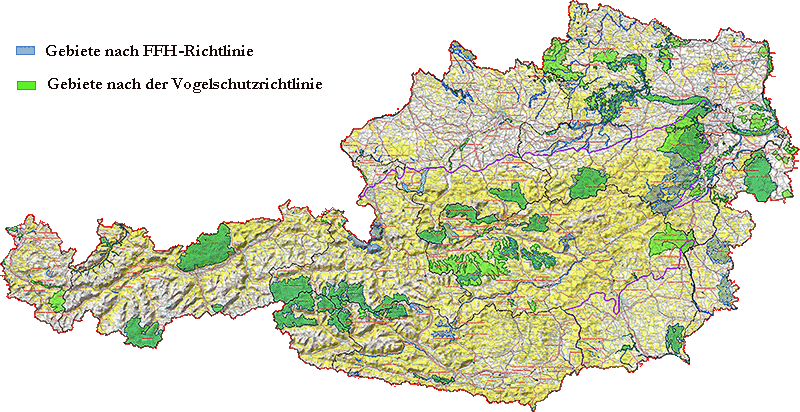
Abb. II.11: Die Natura2000-Gebiete in Österreich. © A. Hassl.
Ein interessanter Aspekt, der - falls er auftritt - im Rahmen der Evolution wohl zu den historischen Einflüssen gerechnet werden muss, ist die beabsichtigte, ⇒ anthropogene Veränderung von europäischen Lebensräumen durch den Aufbau des Schutzgebietsnetzwerks Natura2000. Dies ist ein idealerweise zusammenhängendes Netz von Schutzgebieten innerhalb der Europäischen Union, das seit 1992 nach den Maßgaben der Fauna-Flora-Habitat-Richtlinie (Richtlinie 92/43/EWG, kurz FFH-Richtlinie) und der Vogelschutzrichtlinie (Richtlinie 79/409/EWG) errichtet wird. Da der Zweck von Natura2000 die Erhaltung eines günstigen Zustands vom Menschen gemachter und vor allem als Freizeiteinrichtung genutzter, sogenannter „naturnaher” Kulturflächen ist, müssen überbaute und ⇒ ökologisch veränderte, qualitativ abgewertete Flächen durch die Aufwertung anderer Flächen kompensiert werden. Gemessen wird die Erreichung des Zieles von Natura2000 an der Erhaltung von Brut- und Ruhestätten einiger, angeblich ökologisch, in Wahrheit aber touristisch-ökonomisch „wertvoller” Indikatorarten aus mehreren höheren Taxa der Tierwelt. Diese Vorgaben behindern die natürliche Sukzession von Lebensräumen und werden zu einer kostenintensiven Konservierung von Pionierarten in Tiergarten-ähnlichen Kleinsthabitaten führen. Dieser EU-weit oktroyierte und die Großbetriebe fördernde Umbau von Ökosystemen in weiten Teilen Österreichs wird auf die Vektoren- und Parasitenfauna erheblichen Einfluss haben und zu merklichen Verschiebungen der Epidemiologie und Häufigkeit von durch Arthropoden-übertragenen Infektionskrankheiten führen. Diese vorhersehbaren Auswirkungen werden die, die auf Grund von den zivilisatorisch vorgegebenen Veränderung der Lebensräume des Menschen und des globalen Klimas auftreten, überlagern und verdrängen. Prospektive Studien zur Risikobewertung der Natura2000-Massnahmen wurden allerdings nirgendwo in Europa initiiert.
Ökologische Einflüsse
Die ökologische Begründung besagt, dass die Begrenzungen des Verbreitungsareals einer Art durch die &ou- schen Faktoren im kontinentalen Maßstab erzwungen werden. Das Areal widerspiegelt die über längere Zeitspannen konstanten Umweltparameter eines Ökosystems, wie zB Durchschnittstemperaturen und Niederschlagsmenge. Die Verbreitungsareale sind dann häufig in Landschaftstypen eingebettet, also zB die typische Verbreitung einer Halbwüsten-bewohnenden Zecke. Die gelegentlich besonders herausgehobenen ⇒ anthropogenen Einflüsse, mit dem Modewort Globalisierung bezeichnet, gehören in dieses ökologische Modell. Denn, bei einer genaueren Betrachtung dieses Phänomens ist nicht die anthropogene Verschleppung von Tieren der entscheidende Punkt, sondern die Umgestaltung der Lebensräume durch den Menschen und durch seine Nutztiere und -pflanzen. Nach einer für einen Neobioten günstigen Umgestaltung eines Lebensraums wird dieser Organismus über kurz oder lang auch auf natürliche Weise einwandern, möglicherweise einige Zeit später als bei einer Einschleppung durch menschliche Aktivitäten. Es ist die hohe ⇒ Abundanz von Haushunden und deren Aufbewahrungsstätten in der Kulturlandschaft, die die Ausbreitung der Braunen Hundezecke Rhipicephalus sanguineus nach Nordeuropa ermöglicht, nicht deren immer wieder beklagte Verschleppung mittels nordwärts führender Transporte von vermeintlich armen, streunenden Hunden aus den Mittelmeerstaaten durch Touristen. Die Schwäche des ökologischen Modells ist die Vernachlässigungen der Wechselwirkung der stetigen Veränderung aller Landschaftstypen und - im weiten Sinne des Begriffs gesehen - auch die der Lebensgemeinschaften, also die Negation des Faktors Zeit zur Anpassung.
Der „Klimawandel”
Vor allem in populärmedizinischen Veröffentlichungen und in der Presse werden immer wieder apokalyptische Szenarien von zukünftigen Überflutungen der Menschheit mit Krankheitserregern und -überträgern, ausgelöst durch eine weltweite Erwärmung, gezeichnet. In diesen Horrorszenarien fehlen selten nur die Zecken, von denen erzählt wird, dass tropische Arten bei uns einwandern, alle Zecken zukünftig in viel größerer Häufigkeit auftreten und deswegen viel mehr Krankheitsfälle in der Bevölkerung zu verzeichnen sein werden. In solchen Darstellungen werden die biologischen Beschränkungen der Ausbreitung einer Art meist völlig negiert und Fakten zur ⇒ Abundanz, zum Verbreitungsareal und zur Epidemiologie wahllos miteinander vermengt. So kann zB ein bestimmter ⇒ Biotop nur eine bestimmte Menge an blutsaugenden Ektoparasiten beherbergen, da die Anzahl an verfügbaren Wirtsorganismen durch Zuzug neuer Parasiten nicht steigt. Das häufig gehörte Argument des alternativen Saugens an nicht-humanen Wirten geht ins Leere, da ja in diesem Fall auch keine Erreger auf den Menschen übertragen werden bzw der Mensch gar nicht belästigt wird. Zudem muss ein infektiöser Erreger, dh eine Art, die eine Krankheit erregen kann, mit der Wirtspopulation in ein Gleichgewicht kommen. Ansonsten rottet sie sich selbst rasch wieder aus. Zudem war das Klima in den letzten 10 000 Jahren keineswegs konstant, auf nachweislich wärmere Jahrhunderte folgten kältere. Zusammen mit der - auch aus natürlichen Ursachen erfolgten - vollkommenen Wandlung der europäischen Landschaft, Flora und Fauna entstehen immer neue Ökosysteme und etablierte verschwinden wiederum - ebenso wie Pflanzen- und Tierarten. Es ist daher grundsätzlich nicht vorhersehbar, wie sich die gegenwärtige weltweite Erwärmung auf die Zeckenfauna Österreichs und auf die Epidemiologie der Zecken-übertragenen Infektionen auswirken wird. Mutmaßungen darüber sind zwar im populärwissenschaftlichen Bereich erlaubt, sollten aber als solche gekennzeichnet werden, und dürfen nicht als endgültige Wahrheiten in prophetischer Weise verkündet werden. Seriöse Wissenschaftler halten sich daher diesem Themenkreis fern.
Aus dem genannten Grund der Nichtvorhersehbarkeit ist die wissenschaftliche Durchdringung des Themas „Zecken und der Klimawandel” minimal. In einer Übersichtsarbeit zu diesem Thema wird erwähnt, dass eine 30-Jahre dauernden Studie zum Ergebnis kam, dass der Gemeine Holzbock, Ixodes ricinus, in dieser Zeit sein Verbreitungsareal um 9,9% nach Norden erweiterte. Ferner dehnt diese Art ihr Areal auch nach Osten aus, ich vermute auf Kosten der Schwesterart, Ixodes persulcatus. cit. Dantas-Torres [2015]. Diese weitgehend unbestrittenen Beobachtungen lassen sich jedoch nicht mit dem Phänomen einer globalen Klimaerwärmung in Verbindung bringen, da eine genaue Festlegung des Anteils der verschiedenen Ursachen für eine solche Faunenveränderung nicht möglich ist. Unbestritten ist, dass einige mediterrane Tierarten nach Österreich einwandern werden oder in den letzten Jahren bereits eingewandert sind, darunter wahrscheinlich auch die eine oder andere Haemaphysalis-Art. Veränderungen in der Zusammensetzung der heimischen Zeckenfauna erfolgten aber nachweislich bereits seit mehreren tausend Jahren und zwar mit und ohne Zutun des Menschen.
Einflüsse der Lebensgemeinschaft (Biozönose)
Unsauber abgetrennt vom vorhergehenden Modell bzw vermischt durch die modische Synonymisierung der Begriffe ⇒ Biotop und ⇒ Habitat werden die Einflüsse der Lebensgemeinschaften auf die Verbreitungsareale. Insbesondere im Falle ⇒ obligatorisch Blut-saugender und ⇒ stenophager Parasiten sind die Verbreitungsareale der Wirtsorganismen der Schlüssel zum Auffinden solcher Schmarotzer. Durch die Anpassung der Zecke an das Leben ihres Wirtsorganismus werden viele ökologische Faktoren angeglichen - im Extremfall einer monophagen Zecke deckt sich das Verbreitungsareal der Zecke mit jenem des Wirtes. Andere biozönotische Einflüsse sind die Existenz von Räubern und von Zerstörern der Eier im Mikrohabitat. Auch die Entwicklung von Abwehrmechanismen der Wirte gegen die Zecke gehört in dieses Modell. Im Falle der Weiterexistenz einer oligophagen Zecken-Art trotz Vollzugs eines Wirtswechsels verändert die Zecke die Lebensgemeinschaft - sie wird zum Evolutionsmotor.
II.8 Ausbreitungsmechanismen
Jede Tier- und Pflanzenart trägt in sich als immanente Eigenschaft die Tendenz, ihr Verbreitungsareal zu vergrößern, um so mehr Individuen existieren zu lassen. Allerdings ist die Fähigkeit zur Neubesiedlung bisher von einer biologischen Art nicht besiedelter Areale von ihrer Migrationsfertigkeit bestimmt. Diese lassen sich grob in arteigene, auf Arealvergrößerung gerichtete Migrationsbefähigungen und in zufällig überlebte Verschleppungsereignisse zerlegen. Letztere mögen zwar spektakuläre Ergebnisse zeitigen, sie sind jedoch für das Existieren einer Art letztlich ohne Bedeutung. Gerichtete Migrationen werden durch von Regeln bestimmten Verbreitungsmechanismen verwirklicht, diese Verbreitungsmechanismen sind für die einzelnen Taxa charakteristisch. Die wesentlichsten Verbreitungsmechanismen im Taxon Zecken sind Transporte auf den und mittels der Wirtstiere, also Phänomene des Transportparasitismus. Dabei gehen natürliche Phänomene und durch den Menschen hervorgerufene oder veränderte Hand in Hand und sind im Einzelfall kaum sauber trennbar. Ein Beispiel dafür ist die Veränderung des Vogelzuges in Europa durch die besseren Überlebenschancen von nicht-ziehenden Kulturfolgern in den winterlichen Siedlungen.
Natürliche Ausbreitung
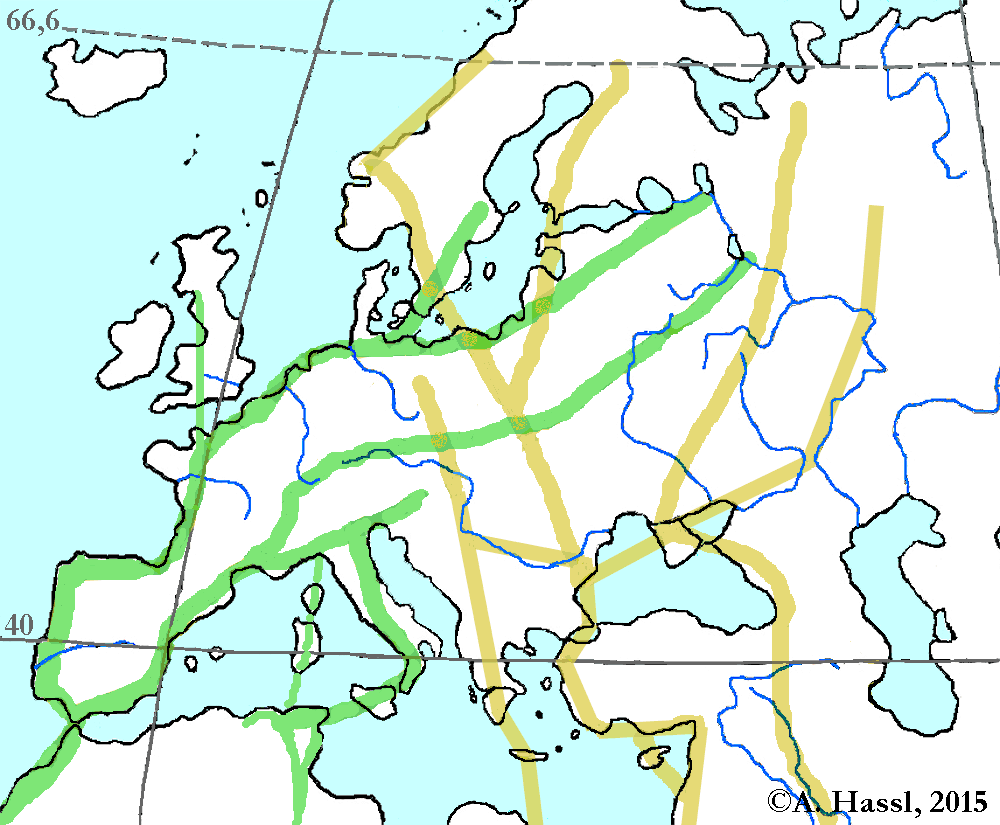
Abb. II.12: Die bedeutendsten Zugstraßen von Zugvögeln in Europa. Grün: Die Westzieher, gelb: Die Ostzieher.
© A. Hassl.
Der biannuale Zug der Vögel ist wohl der bekannteste Weg zur Verschleppung von Zecken. Zugvögel verlassen ihre Brutgebiete im Herbst und kehren im Frühjahr wieder. In Europa ist die Zugrichtung der allermeisten Vögel im Herbst südwärts, die Tiere fliegen in breiter Front. Im Frühjahr geht es nordwärts, allerdings meist verstreut und nicht immer auf derselben Route wie im Herbst. Die bedeutendsten Zugstraßen über Mitteleuropa zerfallen, wie in der Abbildung gut erkennbar, in zwei Gruppen: Vögel, die im Westen Europas direkt nach Afrika ziehen und solche, die über Südosteuropa und Kleinasien fliegen. Ostösterreich und Ungarn liegen unter einem Hauptkreuzungspunkt der zentraleuropäischen Flugschneisen. Insektenreiche ⇒ Biotope wie die Feuchtgebiete um die europäischen Steppenseen werden von den ziehenden Vögeln als Rastplätze bevorzugt. Allerdings müssen einige Bedingungen erfüllt werden, damit es zu einer erfolgreichen Verschleppung von Zecken kommen kann. Erfolgreich - aus Sicht der Zecke bzw des Menschen als Opfer - ist die Verschleppung dann, wenn die eingeschleppte Zecke zumindest eine Blutmahlzeit im neuen Habitat einnehmen kann und dabei Erreger überträgt oder im neuen Habitat Eier legt, aus denen überlebensfähige Larven schlüpfen. Als Bedingungen sind zu nennen:
- Die Vögel müssen rasch genug ziehen, um angesogene Zecken nennenswerte Strecken transportieren zu können. Dies scheint eine wenig problematische Vorraussetzung zu sein, da Zugvögel auf der Reise mit der artspezifisch höchstmöglichen Geschwindigkeit fliegen. Diese ist im Falle von Kleinvögeln zwischen 50 und 70 km/h, bei großen Arten 60 bis 100 km/h. Dabei erreichen die Tiere Tagesleistungen von 100 bis 500 km Flugstrecke. Zwischen den Zugperioden legen die Tiere Pausen von einigen Stunden bis wenigen Tagen ein.
- Die Zecke muss ⇒ ornithophil sein, Teilornithophilie reicht allerdings. Die Entwicklung der Telotropie ist wahrscheinlich auf die hohe Potenz dieses Phänomens zurückzuführen, dadurch eine erfolgreiche Verschleppung der Zecken zu bewerkstelligen.
- Das ornithophile Stadium der Zecke, meist das Nymphenstadium, muss zum Zeitpunkt des Vogelzuges aktiv sein.
Zu rechnen ist mit einer regelmäßigen Einschleppung von Ixodes (Pholeoixodes) arboricola während des Frühjahrszuges und von nordosteuropäischen Zecken, insbesondere der Taigazecke Ixodes persulcatus, während des Herbstzuges. Aus Polen liegt eine Studie vor, die eine natürlich stattfindende Verschleppung von Ixodes festai durch Turdus merula, der Amsel, Haemaphysalis punctata durch Larus marinus, der Mantelmöwe, und Hyalomma marginatum durch Motacilla flava, der Schafstelze, darlegt. cit. Nowak [2010].
Die Wanderungen der Fledermäuse ist der deutlich weniger bekannte Weg zur Verschleppung von Zecken. Alle europäischen Fledermausarten sind einerseits obligatorische Insektenfresser und andererseits mehr oder minder wanderlustig. Der Hauptgrund für die Wanderungen der Fledermäuse ist der europäische Winter und dessen Auswirkungen auf sie. Bei sinkenden Lufttemperaturen nimmt die Anzahl der Insekten, die als Futter benötigt werden, ab. Dadurch wird das Nahrungsangebot für die Fledertiere kleiner, sie müssen in einen frostfreien Winterschlaf gehen. Dieser erfolgt üblicherweise in geschützten Hohlräumen, die aber nicht überall zu finden sind. Die Ansprüche an frostgeschützte Überwinterungsplätze sind andere als jene an die sommerlichen Tagesruhestätten. Die Tiere ziehen im Herbst meist von Nord- und Osteuropa nach Süden und Westen. Fledermäuse aus dem Baltikum fliegen mitunter bis nach Südfrankreich. Dabei legen sie eine Distanz von mehr als eintausend Kilometern Luftlinie zurück. Solche Fernwanderer sind beispielsweise der große und der kleine Abendsegler. Im Falle der Kurzstreckenwanderer liegen die Sommer- und die Winterquartiere nah beieinander. Dazu gehört zB die Zwergfledermaus.
Wichtige Voraussetzungen für eine Verschleppung von Zecken sind die einerseits die Tageswanderungen der Fledermäuse, dann die Dauer des Aufenthalts der Zecke auf dem Wirt und - damit verbunden - die Zugehörigkeit der Zecke zur Höhlenfauna, und die Intensität der Geselligkeit der Fledermäuse. Auf Grund der Lebensweise der Fledermäuse gibt es nur wenige Kontaktmöglichkeiten zwischen deren Zeckenfauna und dem Menschen. Die Fledermauszecken eignen sich auch nicht als ⇒ Reservoire oder Verschlepper für humanpathogene Erreger. Sie bedrohen daher kaum die Gesundheit des Menschen außer in den wenigen Fällen von Attacken auf Höhlenfahrer.
Anthropogene Ausbreitung
Die ⇒ anthropogene Verschleppung von Zecken ist eine unfreiwillige, wenn auch nicht unvorhersehbare und eine fahrläss- rkung der Globalisierun- Form der Gebietsausweitung von Zecken-Arten, deren Existenz durch die Aktivität des Menschen gefördert wird, erfolgt insbesondere durch Viehtransporte. Durch den Menschen eingeschleppte und dann hier in ⇒ Zentraleuropa Populationen bildende Zecken sind aber keinesfalls ein neuzeitliches Phänomen, wie gelegentlich postuliert. Seit Haustiere und Vieh gehandelt wird, kommt es regelmäßig zur Verschleppung armentophiler Zecken. Die allermeisten davon überleben allerdings den mitteleuropäischen Winter nicht oder finden sonst hier keine geeigneten ⇒ Biotope. Sich verändernde Lebensstile der Mitteleuropäer erzeugen aber immer neue, andersartige und nun vielleicht geeignete Biotope für eingeschleppte Zecken. Entscheidend für die Eigenschaft ⇒ „Neozoon” ist die Etablierung einer stabilen Population einer gebietsfremden Art, nicht deren purer Fund. Folgend werden daher nur jene Zecken-Arten aufgeführt, die sehr wahrscheinlich vom Menschen nach ⇒ Zentraleuropa gebracht wurden und die sich hier zumindest über einige Generationen ansiedeln konnten, unabhängig vom Zeitpunkt dieses Ereignisses. Dabei ist immer im Auge zu behalten, dass professionelle Tierhalte- und Tierverkaufseinrichtungen wie zB Zoos kein gesteigertes Interesse am Bekanntwerden einer Besiedlung ihrer Einrichtungen durch exotische Zecken haben. Deshalb wird die Existenz einer Dunkelziffer solcher Fälle in beachtlicher Höhe vermutet.
- Unklar ist der Fall der Hühnerzecke, Argas persicus. Dieses vermutlich aus den Tropen oder den Subtropen stammende Tier könnte bereits im Rahmen der landwirtschaftlichen Revolution des Neolithikums auf Hühner nach ⇒ Zentraleuropa verschleppt worden sein. Wahrscheinlich er ist allerdings eine spätere Verschleppung, da die Tiere bis heute auf das Leben im Hühnerstall beschränkt sind und die ersten Hühner ⇒ ⇒ Zentraleuropas frei-laufend gehalten wurden.
- Bereits in der Antike erfolgte die Besiedlung ⇒ ⇒ Zentraleuropas durch die im Rahmen der Auspizien aus dem Mittelmeerraum eingeschleppte Taubenzecke Argas reflexus.
- Mittels Hunden: Im 19. Jahrhundert soll die Braune Hundezecke, Rhipicephalus sanguineus, von Italien nach Warschau verschleppt worden sein. cit. Nowak [2010].
- Mittels Vögel als Heimtiere: Darüber sind keine Angaben bekannt.
- Mittels Reptilien als exotische Hausgenossen: Durch die inzwischen weitgehend illegalen unkontrollierten Importe von exotischen Tieren aus den Hepetotaxa wurden und werden exotische Zecken eingeschleppt. In einer Studie aus Polen (cit. Nowak [2010]) wurden eine Einschleppung folgender ⇒ herpetophager Zecken nachgewiesen:
- Amblyomma latum Koch, 1844;
- Amblyomma nuttalli Dönitz, 1909;
- Amblyomma quadricavum (Schulze, 1941);
- Amblyomma transversale (Lucas, 1844);
- Amblyomma varanense (Supino, 1897); sowie die
- Mediterrane Schildkrötenzecke, Hyalomma aegyptium (Linnaeus, 1758).
II.9 Gefährdung und Schutz
Abb. II.13: Eine vanishing tick species. Verändertes Titelbild des Artikels von Durden et Keirans [1996] über potentiell vom Aussterbenden bedrohte Zecken-Arten.
Zecken als ⇒ obligatorische ⇒ Ektoparasiten sind ein gleichberechtigter Teil der belebten Welt wie jedes andere Lebewesen auch. Wie alle anderen Lebewesen, die in einem ⇒ Biotop miteinander und interagierend leben, stellen auch die Zecken einen wesentlichen Knotenpunkt des Netzwerks dar, das ein Ökosystem bildet. Der Ausfall so eines Knotens hinterlässt eine merkbare, in manchen Fällen eine nicht mehr reparierbare Lücke. Obgleich Zecken meist mit Abscheu betrachtet werden, und viele Artenschützer es als ihre Kernaufgabe ansehen, die von ihnen betreuten Tiere von diesen Parasiten zu befreien, führt die Ausrottung einer Zecken-Art zu einem mindestens ebenso großen Schaden im Ökosystem wie beispielsweise das Aussterben des Großen Pandabären. Das Interesse des Publikums und das der Medien sowie die kommerzielle Verwertbarkeit unterscheiden diese beiden Ereignisse jedoch erheblich.
Gefährdet ist eine Zecken-Art immer dann, wenn sie eine Spezies ist, die
- 01. ein relativ kleines und ökologisch gefährdetes Verbreitungsgebiet hat, vorzugsweise eine einzige Insel, auch wenn diese relativ groß ist wie zB Madagaskar; und sie
- 02. ein weitgehend monophager Wirtsspezialist mit nur einem Wirtstier ist, das heute nur mehr in geringer ⇒ Abundanz auf relativ kleiner Fläche auftritt. Insbesondere Zecken-Arten, von denen zumindest ein Stadium ausschließlich an einer Art von großen Wirbeltieren mit potenziell gefährdeten Populationen saugt, sind hier eingeschlossen.
Es ist nicht bekannt, ob in historischer Zeit eine Zecken-Art vom Menschen ausgerottet wurde oder aus natürlichen Ursachen ausgestorben ist. Derzeit gelten unter Anwendung der oben dargelegten Prämissen 34 Zecken-Arten als potentiell gefährdet. Für das Staatsgebiet von Österreich sind zu diesem Thema keine Daten zu finden, in den „Roten Listen Österreich” fehlt das Taxon Ixodidae. Eine zumindest regional anerkannt gefährdete Zecken-Art ist Amblyomma geochelone. Diese Tiere leben nur auf Madagaskar und sie saugen vermutlich ausschließlich an der „vom Aussterben bedrohten” (IUCN) Madagassischen Schnabelbrustschildkröte Astrochelys yniphora Blut. cit. Durden et al. [2002]. Bislang fehlen allerdings überprüfbare Nachrichten und Veröffentlichungen über in concreto durchgeführte Schutzprogramme zum Erhalt solcher gefährdeter Zecken-Arten. In Neuseeland ist eine Art, Ixodes anatis, in ein nationales Erhaltungsprogramm aufgenommen worden. cit. Kwak et Heath [2018]. Gerüchteweise sollen von zumindest einer gefährdeten Zecken-Art die DNS durch Tieffrieren konserviert worden sein, um die Art zu erhalten. Dieses Vorgehen wird von mir allerdings nicht als redlicher Beitrag zum Erhalt der ⇒ Biodiversität gesehen. Mit so einem Ansatz wird die Evolution ausgeschaltet, die Biospezies verkommt als tiefgefrorenes Denkmal ihrer selbst, und kommerzielle Interessen in Form eines „Jurassic Parks” werden fördernd bedient.
Die unten stehende Tabelle II.1 der vom Aussterben bedrohten Zecken-Arten wurde von mir unter Einbeziehung der Angaben von Durden et Keirans [1996], Durden et al. [2002], Ash et al. [2017] und Kwak et Heath [2018] erstellt und sie wird bei Gelegenheit aktualisiert.
| Tab. II.1: Vom Aussterben bedrohte Zecken-Arten der Welt | ||
|---|---|---|
| Zeckenart | Wirte | Vorkommen |
| Argas echinops | Tenreks | Madagaskar |
| Argas transversus | Galapagos-Riesenschildkröte | Galapagos-Inseln |
| Nothoaspis reddelli | Fledermäuse | Mexiko |
| Omithodoros galapagensis | Drusenköpfe, Galapagos-Landleguane | Galapagos-Inseln |
| Amblyomma babirussae | Molukken-Hirscheber | Mangole, Taliabu und Buru |
| Amblyomma boulengeri | Kielschwanzleguane | Galapagos-Inseln |
| Amblyomma chabaudi | Spinnenschildkröte | Madagaskar |
| Amblyomma crenatum | Java-Nashorn | Südasien |
| Amblyomma echidnae | Ameisenigel | Australien |
| Amblyomma geochelone | Madagassische Schnabelbrustschildkröte | Madagaskar |
| Amblyomma komodoense | Komodowaran | Komodo-Inseln |
| Amblyomma macfarlandi | Galapagos-Riesenschildkröte | Galapagos-Inseln |
| Amblyomma pilosum | Galapagos-Riesenschildkröte | Galapagos-Inseln |
| Amblyomma robinsoni | Komodowaran | Komodo-Inseln |
| Amblyomma sphenodonti | Brückenechse | Neuseeland |
| Amblyomma squamosum | Pazifikwaran | Guam |
| Amblyomma tuberculatum | Georgia-Gopherschildkröte | Florida und Umgebung |
| Amblyomma williamsi | Drusenköpfe | Galapagos-Inseln |
| Cosmiomma hippopotamensis | Afrikanische Nashörner | Südafrika |
| Dermacentor rhinocerinus | Afrikanische Nashörner | Südafrika |
| Haemaphysalis simplicima | Tenreks | Madagaskar |
| Haemaphysalis subelongata | Tenreks | Madagaskar |
| Haemaphysalis theilerae | Tenreks | Madagaskar |
| Haemaphysalis tiptoni | Tenreks | Madagaskar |
| Ixodes anatis | Kiwis | Neuseeland |
| Ixodes galapagoensis | Galapagos-Schildreisratte | Galapagos-Inseln |
| Ixodes lemuris | Lemuren | Madagaskar |
| Ixodes lunatus | Tenreks | Madagaskar |
| Ixodes okapiae | Okapi | Zentralafrika |
| Ixodes omithorhynchi | Schnabeltier | Australien |
| Ixodes peromysci | Weißfußmäuse | Santa-Barbara-Inseln |
| Ixodes vestitus | Ameisenbeutler | Australien |
| Ixodes woyliei | Bürstenschwanz-Rattenkänguru | Australien |
| Ixodes zaglossi | Ameisenigel | Neuguinea |
 Andreas R. Hassl
Andreas R. Hassl