VIII.2 Dermacentor Koch 1844
Inhaltsverzeichnis:
- VIII.2.1Kurzbeschreibung der Gattung
- VIII.2.2Bestimmungsschlüssel für Männchen und Weibchen der beiden heimischen Arten
- VIII.2.3Kurzbeschreibung von in Europa nachgewiesenen Dermacentor-Arten,die aber in Zentraleuropa mit hoher Wahrscheinlichkeit nicht vorkommen
- ❍Dermacentor pomerantzevi
- VIII.2.4Einzelbeschreibung der Dermacentor-Arten,die in Zentraleuropa heimisch sind oder mit hoher Wahrscheinlichkeit vorkommen
- ❍Dermacentor marginatus
- ❍Dermacentor reticulatus
VIII.2.1 Kurzbeschreibung der Gattung
- Benennung: Schildzecken - Hard Ticks - Ixodidés - garrapatas duras
- Klassifikation nach ICD-10-GM: B88.2 Sonstiger Befall durch Arthropoden
- System (Reich/Stamm/Klasse/Ordnung/Familie): Metazoa/Arthropoda/Arachnida/Ixodida/Ixodidae
- Artenzahl: Dermacentor: 40 Arten im Jahre 2020, in Österreich sind zwei Arten nachgewiesen
- Charakteristik: Drei-wirtiger, temporärer, obligatorischer, euryxener, telmophager, ektoparasitischer Blutsauger
- Status: Erreger und Vektor
- Größe: Bis 6 mm
- Übertragungsart: Beim Blutsaugen mit dem Speichel
- Wirtsspektrum: Breit, große und kleine Säugetiere, auch der Mensch
- Verbreitung: Kosmopolitisch außer Australien, insbesondere aber nearktisch, zwei Arten heimisch
- Entwicklung: Vermutlich ein Larvenstadium, ein Nymphenstadium, getrenntgeschlechtliche Adulte
- Entwicklungsdauer: (E/L/N/A): 21d/??d/bis ?m/bis ??
- Habitate in Zentraleuropa: Trockene und warme Flächen, Viehweiden, die Subadulten in den Schlaf- und Rastplätzen der Wirte
Abb. VIII.2.1: Ein Lebensbild einer Zecke der Gattung Dermacentor.
© unbekannt.
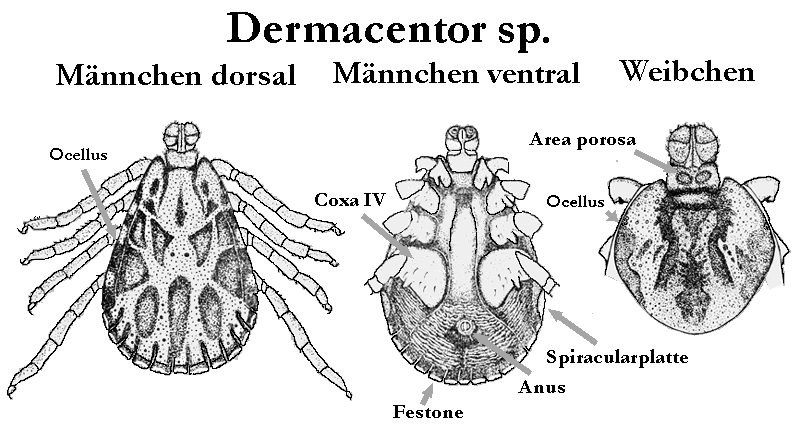
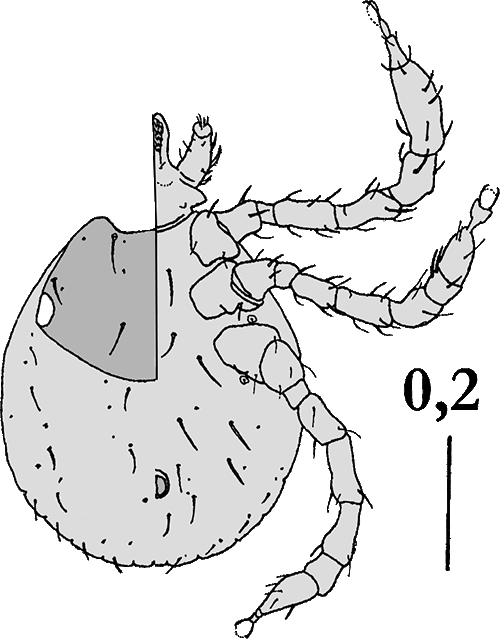
Der Name der Gattung Dermacentor leitet sich von altgriechisch δερμα derma = Haut & κεντω kento = stechen ≈ „Hautstecher” ab. Zirka ein Drittel aller Arten dieser Gattung lebt in Afrika, sonst sind diese Zecken kosmopolitisch zu finden, mit einem Schwerpunkt in der Nearktis. In Australien gibt es keine indigenen Dermacentor-Zecken. Die Tiere sind sehr auffällig gezeichnet, häufig geradezu hübsch anzusehen. Speziell die Männchen besitzen ein bunt schillerndes, manchmal blau opalisierend gefärbtes Schildes. Dieses ist in diesem Fall mit einem hellen „Emailpigment” bedeckt, das aus Ausscheidungsprodukten des Nukleinsäurestoffwechsels besteht. Auch an den ⇒ Palpen und am ⇒ Capitulum gibt es weiße Pigmentflecke. Fast alle Arten sind drei-wirtig. Als Erkennungsmerkmal der Gattung dienen die am seitlichen Außenrand des ⇒ Scutums befindlichen, gut entwickelten, flachen oder etwas ⇒ konvex gewölbten Augen und die am Hinterende des Körpers sitzenden elf Festone. Auf der Bauchseite des Männchens gibt es keine Platten. Die Analfurche umgibt den ⇒ Anus distal.
Zecken der Gattung sind wichtige ⇒ Vektoren von humanpathogenen Mikroorganismen in den Vereinigten Staaten von Amerika, in Europa sind sie von untergeordneter Bedeutung. Sie übertragen die Erreger der Tularämie Francisella tularensis (McCoy et Chapin, 1912), des Rocky-Mountains-Fleckfiebers Rickettsia rickettsi Brumpt, 1922, des sibirischen Zeckenbissfiebers Rickettsia conorii Brumpt, 1932, Rickettsia sibirica Zdrodovski et Golinevich, 1948, Rickettsia australis Philip, 1950, des Q-Fiebers Coxiella burnetii (Derrick, 1939), der Rinderanaplasmose, und der Hundebabesiose Babesia canis (Piana et Galli-Valerio, 1895). Der Speichel einiger Arten löst eine manchmal lebensbedrohende ⇒ Paralyse aus.
Genus-Synonyme sind Acarus Fabricius, 1794; Ixodes Latreille, 1796; Cynorchaestes Hermann, 1804; Crotonus Dumeril, 1829; Pseudoixodes Haller, 1882; Dermacentorites Olenev, 1.931; Amblyocentor Schulze, 1932; Indocentor Kohls, 1950; Subg. Dermacentor Tendeiro, 1962.
Innerhalb der Gattung Dermacentor werden mehrere Untergattungen unterschieden. Deren Einteilung erfolgt nach der ⇒ Bedornung von Bein- und Palpen-Segmenten und nach der Ausbildung der Pigmentierung. In ⇒ Zentraleuropa kommen allerdings nur zwei Dermacentor-Arten vor, D. marginatus und D. reticulatus. Die beiden Arten lassen sich in der Praxis als Adulttiere adspektorisch relativ leicht unterscheiden, obgleich die beiden Arten, vermutlich gute Arten, in den Merkmalen sich überschneidende Phänotypen ausbilden können. Solche Formen lassen sich dann nur mit genetischen Verfahren differenzieren. cit. Zahler et al. [1995]. Für die Larven und Nymphen gibt es derzeit keinen Bestimmungsschlüssel auf ⇒ morphologischer Basis.
VIII.2.2 Bestimmungsschlüssel
Bestimmungsschlüssel für die Weibchen und Männchen:
VIII.2.3 Kurzbeschreibung von in Europa nachgewiesenen Dermacentor-Arten, die aber in Zentraleuropa mit hoher Wahrscheinlichkeit nicht vorkommen
Dermacentor pomerantzevi Serdjukova, 1951
Diese Spezies wurde auf Grund eines einzigen Weibchens beschrieben, das im August 1949 von einem Igel in der Nähe von Wolgograd (Stalingrad) gesammelt wurde. cit. Arthur [1960]. Weitere Informationen zu dieser Zecke liegen bis heute nicht vor. Manchmal wird das ⇒ Epitheton „pomerantsevi” geschrieben.
Obgleich in der Fauna europaea das Vorkommen von zwei weiteren Dermacentor-Arten, D. albopictus oder D. albipictus und D. sinicus in Europa vermerkt wird, kann es sich bei diesem Datensatz nur um einen Flüchtigkeitsfehler handeln, ist doch die eine Art, falls sie eine gute Art sein sollte, ein Bestandteil der nordamerikanischen Fauna und die andere lokal in Ostchina verbreitet.
VIII.2.4 Einzelbeschreibung der Dermacentor-Arten, die in Zentraleuropa heimisch sind oder mit hoher Wahrscheinlichkeit vorkommen
Dermacentor marginatus (Sulzer), 1776
dt: Schafzecke
Abb. VIII.2.3: Dermacentor marginatus ♂.
© unbekannt.
Dermacentor marginatus ist eine in ihrem äußeren Erscheinungsbild sehr variable Zecken-Art. Daher wurden über die Jahrhunderte ihres Bekanntseins viele Varianten unter eigenem Namen beschrieben, aber auch andere Arten und Subspezies in das ⇒ Taxon eingereiht. Die Situation der Synonymisierung ist außerordentlich unübersichtlich und jeder Monograph dieser Zecken-Art vertritt seine eigene Meinung zur Zugehörigkeit einer bestimmten Form zu einem Taxon. Ich gebe jene Angaben wieder, die mir am meisten plausibel erscheinen, jedoch ohne Gewähr auf Richtigkeit. In der Darstellung der Art folge ich weitgehend der Wiederbeschreibung durch Estrada-Peña et Estrada-Peña [1991].
Synonyme:
Acarus marginata (Sulzer, 1776); unklare Priorität des ⇒ Epithetons.
Acarus marginata Sulzer, 1776;
Ixodes marginatus Sulzer, 1776;
Cynorhaestes marginatus (Sulzer), 1776;
Ixodes marginatus Fabricius, 1805;
Ixodes marmoratus Risso, 1826;
Crotonus variegatum Duméril, 1829;
Dermacentor parabolicus Koch, 1844; unsichere Zuordnung.
Dermacentor dentipes Koch, 1844;
Haemaphysalis marmorata Berlese, 1888;
Ixodes hungaricus Karpelles, 1893;
Dermacentor reticulatus niveus Neumann, 1897;
Dermacentor reticulatus reticulatus Neumann, 1897 & 1911;
Dermacentor reticulatus Hirst, 1916;
Dermacentor niveus Yakimov, 1923;
Dermacentor marginatus gynaecoides Olenev, 1927;
Dermacentor marginatus longecoxalis Olenev, 1927;
Dermacentor rotundicoxalis Olenev, 1927;
Dermacentor longicoxalis Olenev, 1927;
Dermacentor niveus daghestanicus Olenev, 1928;
Cynorhaestes marginatus Schulze, 1929;
Dermacentor silvarum Olenev, 1931;
Dermacentor marginatus lacteolus Schulze, 1933;
Dermacentor daghestanicus Schulze, 1933;
Dermacentor variatus Oudemans, 1936;
Dermacentor niveus Sénevet, 1937;
Dermacentor aulicus Roman & Jehl, 1948;
Dermacentor antrorum Reznik, 1950;
Dermacentor (Kohlsiella) antrorum Santos Dias, 1963;
Dermacentor niveus Arthur, 1960.
Phylogenie: Ein nicht vollständiges Exemplar einer Zecke, die von Dermacentor marginatus nicht unterscheidbar war, wurde am Ohr eines im Erdpech der Ukraine versunkenen und konservierten Wollhaarnashorns Coelodonta antiquitatis Blumenbach, 1799 gefunden. Das geologische Alter des Fundes konnte 1916, zum Zeitpunkt der Veröffentlichung des Fundes, im österreichischen Galizien nicht bestimmt werden. Wollhaarnashörner lebten vor 550 000 bis vor 12 000 Jahren. Man nimmt allerdings an, dass sie in einer Kältesteppe lebten, einer für Zecken denkbar ungeeigneten Umgebung. cit. Schille [1916]. Der Verbleib des Fundes ist unbekannt.
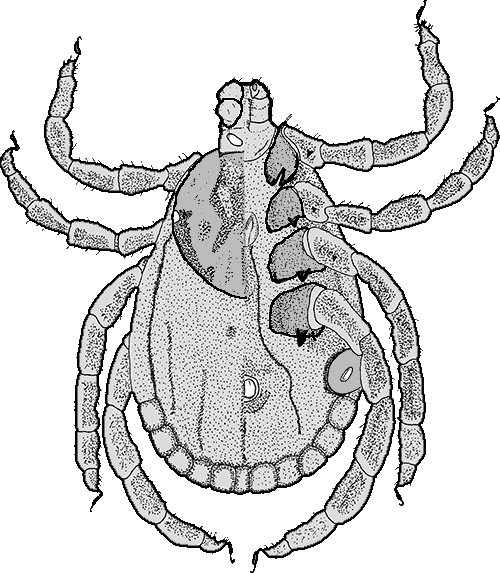 Weibchen: Die nüchternen weiblichen Zecken dieser Art
Weibchen: Die nüchternen weiblichen Zecken dieser Art 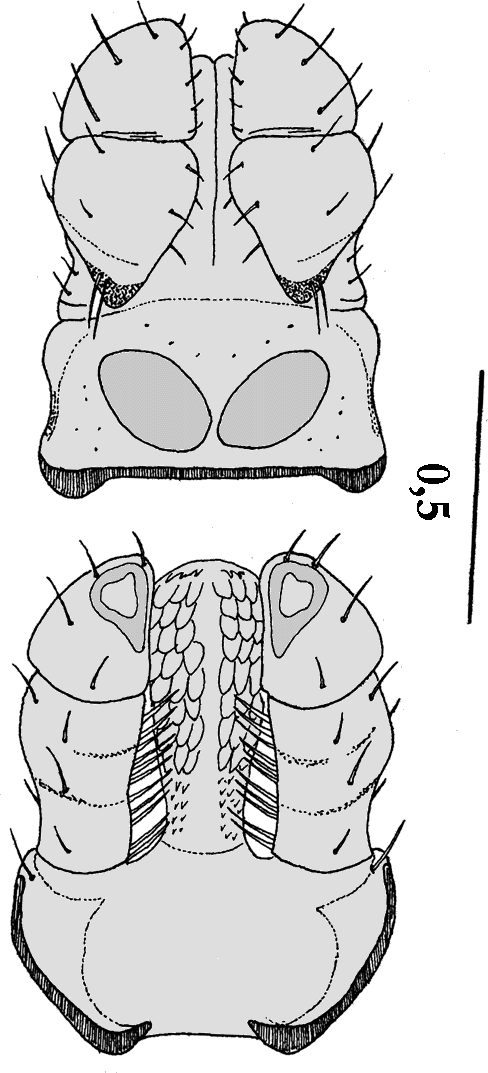 sind sind im Leben von hellrot bis schwarz gefärbt. Sie sind 4,25 bis 6,5 mm, nach anderen Angaben 6,1 mm lang und 3,2 bis 4,25 mm breit. Vollgesogen sind sie 17,3 mm lang und 10,4 mm breit. cit. Ionita et al. [2008]. Dorsalseite: Das Scutum ist geringfügig länger als breit, etwa 1,9 mm lang und 1,7 mm breit und rundlich. In der Abbildung links ist es deutlich an der Musterung zu erkennen. Es ist im Leben metallisch-weiß bis schmutzigweiß ornamentiert und durch die Punktierung zusätzlich geschmückt. Dunklere Stellen befinden sich vor allem in Nähe der Zervikalfurchen, der Augen, sowie an den Seiten und hinten. Die Augen sitzen an der breitesten Stelle. cit. Nosek et Sixl [1972]. Die Scapulae sind groß und spitz. Die Zervikalfurchen sind schmal und lang. Sie nähern sich bis der Schildmitte an, danach laufen sie auseinander und erreichen fast den hinteren Schildrand. Das ⇒ Capitulum ist doppelt so lang wie breit und etwa 774 bis 948 μm lang. Die ⇒ Basis capituli ist rechteckig. An den beiden hinteren Enden sitzen große, subdreieckige, stumpfe ⇒ Cornua. Die Außenseiten der Basis capituli gehen nach vorne leicht zusammen, nach anderen Autoren zusammen. Die ⇒ Areae porosae sind groß, rund oval bis eiförmig und in einem Winkel von etwa 90° zueinander angeordnet. Vor ihnen sitzen in einem Bogen 12 Borstenhaare (⇒ Setae). Die Palpen sind 590 bis 650 μm lang. Das zweite Glied der Palpen ist etwas länger als das dritte. Die Nahtlinie zwischen ihnen ist deutlich sichtbar. Auf der inneren, unteren Seite der Palpenglieder sitzen kräftige sichelförmige Borstenhaare (Setae). Das ⇒ Hypostom ist im vorderen Drittel am breitesten. Die Hypostomspitze hat zwei etwas ⇒ konkav gekrümmte Seiten. Die Zähne sind in je zwei Längsblöcken angeordnet, die Zahnformel lautet 3-3, 3,5-3,5 oder 4-4 in 9 oder 10 bis 12 Querreihen. Die beiden äußeren Reihen bestehen aus spitzen, die innere aus stumpfen Zähnen. Nach unten werden sie allmählich kleiner. Unten in der Mitte liegt ein großer dreieckiger zahnfreier Bereich. Die Spitze des ⇒ Hypostoms ist mit winzigen Zähnchen bedeckt.
sind sind im Leben von hellrot bis schwarz gefärbt. Sie sind 4,25 bis 6,5 mm, nach anderen Angaben 6,1 mm lang und 3,2 bis 4,25 mm breit. Vollgesogen sind sie 17,3 mm lang und 10,4 mm breit. cit. Ionita et al. [2008]. Dorsalseite: Das Scutum ist geringfügig länger als breit, etwa 1,9 mm lang und 1,7 mm breit und rundlich. In der Abbildung links ist es deutlich an der Musterung zu erkennen. Es ist im Leben metallisch-weiß bis schmutzigweiß ornamentiert und durch die Punktierung zusätzlich geschmückt. Dunklere Stellen befinden sich vor allem in Nähe der Zervikalfurchen, der Augen, sowie an den Seiten und hinten. Die Augen sitzen an der breitesten Stelle. cit. Nosek et Sixl [1972]. Die Scapulae sind groß und spitz. Die Zervikalfurchen sind schmal und lang. Sie nähern sich bis der Schildmitte an, danach laufen sie auseinander und erreichen fast den hinteren Schildrand. Das ⇒ Capitulum ist doppelt so lang wie breit und etwa 774 bis 948 μm lang. Die ⇒ Basis capituli ist rechteckig. An den beiden hinteren Enden sitzen große, subdreieckige, stumpfe ⇒ Cornua. Die Außenseiten der Basis capituli gehen nach vorne leicht zusammen, nach anderen Autoren zusammen. Die ⇒ Areae porosae sind groß, rund oval bis eiförmig und in einem Winkel von etwa 90° zueinander angeordnet. Vor ihnen sitzen in einem Bogen 12 Borstenhaare (⇒ Setae). Die Palpen sind 590 bis 650 μm lang. Das zweite Glied der Palpen ist etwas länger als das dritte. Die Nahtlinie zwischen ihnen ist deutlich sichtbar. Auf der inneren, unteren Seite der Palpenglieder sitzen kräftige sichelförmige Borstenhaare (Setae). Das ⇒ Hypostom ist im vorderen Drittel am breitesten. Die Hypostomspitze hat zwei etwas ⇒ konkav gekrümmte Seiten. Die Zähne sind in je zwei Längsblöcken angeordnet, die Zahnformel lautet 3-3, 3,5-3,5 oder 4-4 in 9 oder 10 bis 12 Querreihen. Die beiden äußeren Reihen bestehen aus spitzen, die innere aus stumpfen Zähnen. Nach unten werden sie allmählich kleiner. Unten in der Mitte liegt ein großer dreieckiger zahnfreier Bereich. Die Spitze des ⇒ Hypostoms ist mit winzigen Zähnchen bedeckt.
 Ventralseite: Die Spirakularplatte ist oval bis halbkreisförmig mit einem postero-dorsalem, dreieckigen Auswuchs. Auf ihr sitzt eine kleine, längliche, glatte Macula. Die Coxen des ersten Beinpaares werden durch einen Längseinschnitt in zwei Teile geteilt, sie sind ⇒ bifid. Der Einschnitt erreicht nicht ganz die Mitte der Coxa. Die Coxen IV sind nicht wesentlich größer als I bis III. Die Coxen des zweiten bis vierten Beinpaares tragen einen gut entwickelten Außendorn. Die Coxa IV ist die größte. Die Beine sind dick. Auf der Unterseite der Beinglieder befinden sich je drei stumpfe, zahnartige Erhebungen, am distalen Ende der Tarsi des ersten Beinpaares sitzt je ein nach hinten gerichteter, krummer Dorn.
Ventralseite: Die Spirakularplatte ist oval bis halbkreisförmig mit einem postero-dorsalem, dreieckigen Auswuchs. Auf ihr sitzt eine kleine, längliche, glatte Macula. Die Coxen des ersten Beinpaares werden durch einen Längseinschnitt in zwei Teile geteilt, sie sind ⇒ bifid. Der Einschnitt erreicht nicht ganz die Mitte der Coxa. Die Coxen IV sind nicht wesentlich größer als I bis III. Die Coxen des zweiten bis vierten Beinpaares tragen einen gut entwickelten Außendorn. Die Coxa IV ist die größte. Die Beine sind dick. Auf der Unterseite der Beinglieder befinden sich je drei stumpfe, zahnartige Erhebungen, am distalen Ende der Tarsi des ersten Beinpaares sitzt je ein nach hinten gerichteter, krummer Dorn.
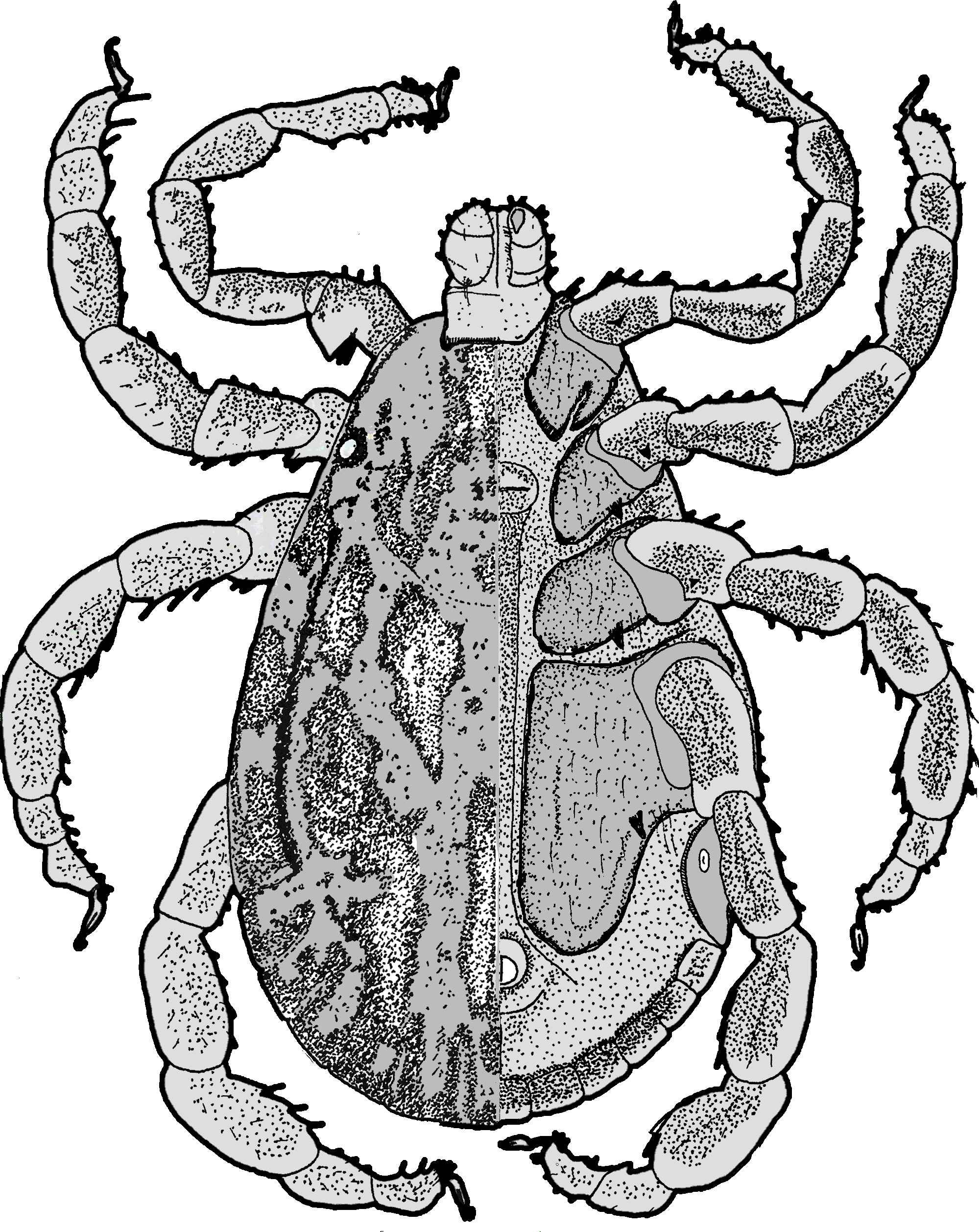 Männchen:
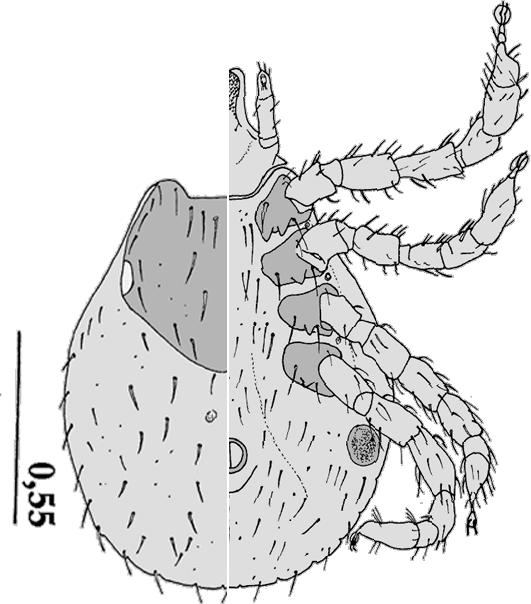
Männchen: 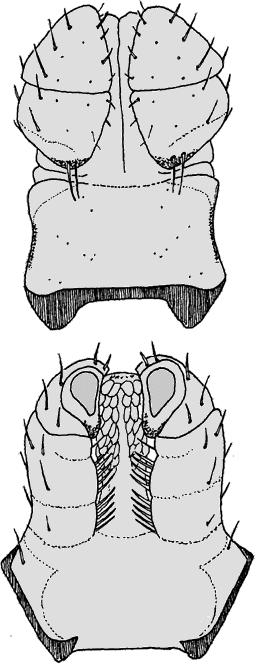 Die Männchen sind im Leben von hellrot bis schwarz gefärbt. Von der Spitze der Palpen bis zum Hinterrand des Schildes beträgt die Körperlänge durchschnittlich 7,25 mm mit einer Schwankungsbreite von 5,25 bis 9,25 mm. Die Breite beträgt 2,75 bis 4 mm. Dorsalseite: Das Schild ist eiförmig, breitoval und hinten breit abgerundet. Es ist glänzend silbrigweiß und ornamentiert. Das Verhältnis Länge zu Breite ist 1,4. Am breitesten ist es auf der Höhe der Spirakularplatten. Die Lateralfurchen sind schmal aber ausgeprägt. Die Zervikalfurchen sind schmal und lang. Die Punktierung besteht aus zwei Größenklassen, die ungleich am Schild verteilt sind. Die Augen sind oval und flach. Die Scapulae sind spitz und liegen eng beieinander. Am Hinterrand sind elf Festons erkennbar. Vor allem an den Furchen und zwischen den Festonen befinden sich dunkelbraune Flecken. Das ⇒ Capitulum ist bei einigen Individuen ebenfalls von einer metallisch-weißen Fleckung überzogen. Es ist 0,7 bis 0,9 mm lang. Die ⇒ Basis capituli ist rechteckig. Ihre Außenseiten stehen parallel zueinander. Der ⇒ posteriore Rand kann leicht ⇒ konkav gekrümmt sein. Auf ihr stehen verstreut Borstenhaare (Setae). Die Basis capituli hat ein Länge zu Breite-Verhältnis von 0,6. Die ⇒ Cornua sind gut entwickelte, spitz, dreieckig und ca 0,3-mal so lang wie die Basis capituli. Die . Die Palpen sind 0,6 bis 0,65 mm lang und damit ca 1,6-mal so lang wie breit. Sie sind breit abgerundet. Das zweite Segment ist 1,3-mal so lang wie breit. Das ⇒ Hypostom ist stumpf, an der Spitze abgerundet, kürzer als die Palpen, im vordersten Viertel am breitesten. Zur Basis hin verjüngt es sich nach und nach, zur Spitze hin plötzlich. Die Zähne sind in je drei Spalten pro Seite angeordnet, Zahnformel lautet daher 3-3, bei einigen Individuen auch 3,5-3,5, in 10 bis 12 Querreihen. Alle Zähne sind spitz.
Die Männchen sind im Leben von hellrot bis schwarz gefärbt. Von der Spitze der Palpen bis zum Hinterrand des Schildes beträgt die Körperlänge durchschnittlich 7,25 mm mit einer Schwankungsbreite von 5,25 bis 9,25 mm. Die Breite beträgt 2,75 bis 4 mm. Dorsalseite: Das Schild ist eiförmig, breitoval und hinten breit abgerundet. Es ist glänzend silbrigweiß und ornamentiert. Das Verhältnis Länge zu Breite ist 1,4. Am breitesten ist es auf der Höhe der Spirakularplatten. Die Lateralfurchen sind schmal aber ausgeprägt. Die Zervikalfurchen sind schmal und lang. Die Punktierung besteht aus zwei Größenklassen, die ungleich am Schild verteilt sind. Die Augen sind oval und flach. Die Scapulae sind spitz und liegen eng beieinander. Am Hinterrand sind elf Festons erkennbar. Vor allem an den Furchen und zwischen den Festonen befinden sich dunkelbraune Flecken. Das ⇒ Capitulum ist bei einigen Individuen ebenfalls von einer metallisch-weißen Fleckung überzogen. Es ist 0,7 bis 0,9 mm lang. Die ⇒ Basis capituli ist rechteckig. Ihre Außenseiten stehen parallel zueinander. Der ⇒ posteriore Rand kann leicht ⇒ konkav gekrümmt sein. Auf ihr stehen verstreut Borstenhaare (Setae). Die Basis capituli hat ein Länge zu Breite-Verhältnis von 0,6. Die ⇒ Cornua sind gut entwickelte, spitz, dreieckig und ca 0,3-mal so lang wie die Basis capituli. Die . Die Palpen sind 0,6 bis 0,65 mm lang und damit ca 1,6-mal so lang wie breit. Sie sind breit abgerundet. Das zweite Segment ist 1,3-mal so lang wie breit. Das ⇒ Hypostom ist stumpf, an der Spitze abgerundet, kürzer als die Palpen, im vordersten Viertel am breitesten. Zur Basis hin verjüngt es sich nach und nach, zur Spitze hin plötzlich. Die Zähne sind in je drei Spalten pro Seite angeordnet, Zahnformel lautet daher 3-3, bei einigen Individuen auch 3,5-3,5, in 10 bis 12 Querreihen. Alle Zähne sind spitz.
 Ventralseite: Die Spirakularplatte ist länglichoval mit einem Vorsprung, sie ist sehr variabel. Die Macula ist groß und länglich. Die Beine sind robust ausgebildet, dorsal ornamentiert außer dem Tarsus und manchmal dem Metatarsus. Die Coxen
Ventralseite: Die Spirakularplatte ist länglichoval mit einem Vorsprung, sie ist sehr variabel. Die Macula ist groß und länglich. Die Beine sind robust ausgebildet, dorsal ornamentiert außer dem Tarsus und manchmal dem Metatarsus. Die Coxen 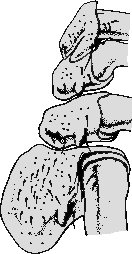 des ersten Beinpaares sind ⇒ bifid, sie werden an der Körperseite durch einen tiefen Einschnitt längs in zwei Teile geteilt, so dass sie adspektorisch in zwei Stacheln enden. Die Coxa IV ist geformt wie das Blatt einer Axt. Die Coxen des zweiten bis vierten Beinpaares tragen je einen Außendorn. An den Trochantern des Beinpaares I bis III sitzen stumpfe Dornen. Am Ende der Tarsi des ersten Beinpaares befindet sich eine nach unten gerichtete spitze Kralle. Die ⇒ Pulvilli sind groß und erreichen fast das Ende der Krallen.
des ersten Beinpaares sind ⇒ bifid, sie werden an der Körperseite durch einen tiefen Einschnitt längs in zwei Teile geteilt, so dass sie adspektorisch in zwei Stacheln enden. Die Coxa IV ist geformt wie das Blatt einer Axt. Die Coxen des zweiten bis vierten Beinpaares tragen je einen Außendorn. An den Trochantern des Beinpaares I bis III sitzen stumpfe Dornen. Am Ende der Tarsi des ersten Beinpaares befindet sich eine nach unten gerichtete spitze Kralle. Die ⇒ Pulvilli sind groß und erreichen fast das Ende der Krallen.
 Nymphe:
Nymphe: 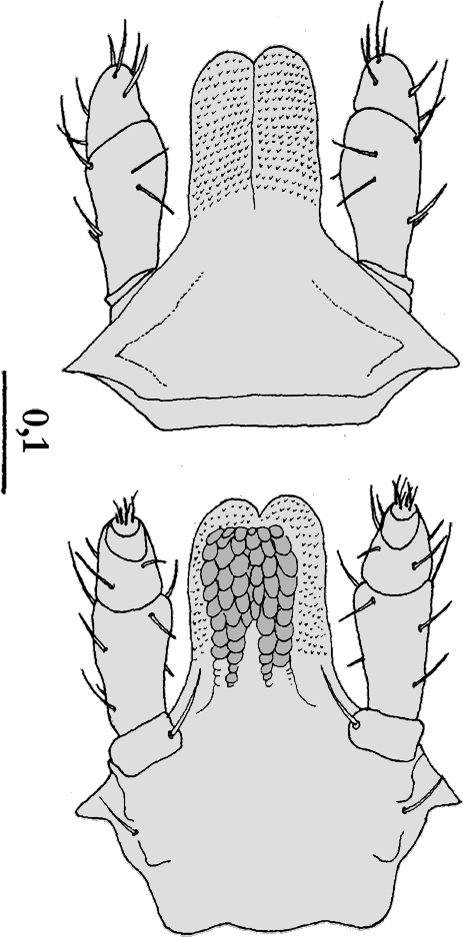 Der Körper ist oval und entweder 1,6 mm lang und 0,9 mm breit oder, wahrscheinlicher, 2,34 bis 2,91 mm lang und 1,02 bis 1,34 mm breit. Dorsalseite: Das Scutum ist 1,1-mal so lang wie breit. Die ⇒ Basis capituli ist drei-mal so breit wie lang. Die Seiten der Basis capituli sind stark zugespitzt. ⇒ Cornua sind vorhanden. Die ⇒ Auriculae sind klein. Die Palpen ähneln jenen der Weibchen, die Außenseiten sind gerade. Das ⇒ Hypostom ist etwa 1,8-mal so lang wie breit, die Spitze ist breit abgerundet. Die Zahnformel lautet 3-3 oder, individuell geprägt, 2-2 in 7 Querreihen.
Der Körper ist oval und entweder 1,6 mm lang und 0,9 mm breit oder, wahrscheinlicher, 2,34 bis 2,91 mm lang und 1,02 bis 1,34 mm breit. Dorsalseite: Das Scutum ist 1,1-mal so lang wie breit. Die ⇒ Basis capituli ist drei-mal so breit wie lang. Die Seiten der Basis capituli sind stark zugespitzt. ⇒ Cornua sind vorhanden. Die ⇒ Auriculae sind klein. Die Palpen ähneln jenen der Weibchen, die Außenseiten sind gerade. Das ⇒ Hypostom ist etwa 1,8-mal so lang wie breit, die Spitze ist breit abgerundet. Die Zahnformel lautet 3-3 oder, individuell geprägt, 2-2 in 7 Querreihen.
Ventralseite: Die Spirakularplatten sind rundlich und besitzen keine dorsal gerichteten Auswüchse. Die Spirakularöffnung liegt nicht ganz in der Mitte. An den Beinen ist die ⇒ bifide Coxa I auffällig, wobei der Außendorn zwar breiter, der Innendorn aber größer ist. Die Coxen II bis IV besitzen einen abgerundeten Außendorn. Auf den Trochantern ventral keinerlei Dornen.
 Larve:
Larve: 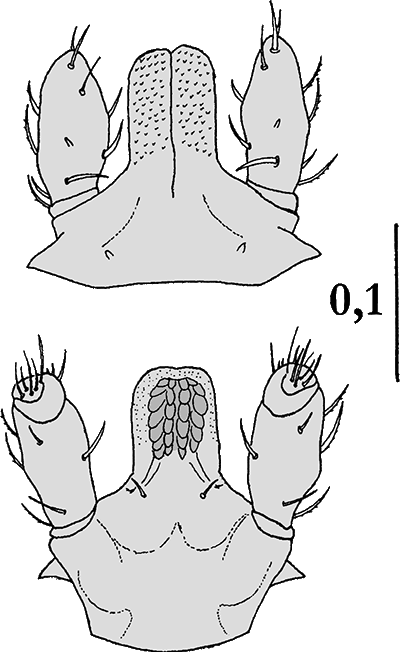 Der Körper ist 0,75 mm oder 0,6 bis 0,64 mm lang und 0,49 mm breit. Das Scutum bedeckt ungefähr die Hälfte des Körpers. Es ist etwa 1,3-mal so breit wie lang. Die ⇒ Basis capituli ist ähnlich jener der Nymphe, die Seiten der Basis capituli erscheinen von oben betrachtet zugespitzt. Die ⇒ Cornua sind auf postero-externale Auswüchse reduziert. Die Palpen ähneln denen der Nymphen. Die Zahnformel lautet 2-2 in 6 Querreihen. Die Coxen I sind nicht ⇒ bifid. Die Coxen II und III besitzen einen abgerundeten Außendorn oder aber Dornen fehlen.
Der Körper ist 0,75 mm oder 0,6 bis 0,64 mm lang und 0,49 mm breit. Das Scutum bedeckt ungefähr die Hälfte des Körpers. Es ist etwa 1,3-mal so breit wie lang. Die ⇒ Basis capituli ist ähnlich jener der Nymphe, die Seiten der Basis capituli erscheinen von oben betrachtet zugespitzt. Die ⇒ Cornua sind auf postero-externale Auswüchse reduziert. Die Palpen ähneln denen der Nymphen. Die Zahnformel lautet 2-2 in 6 Querreihen. Die Coxen I sind nicht ⇒ bifid. Die Coxen II und III besitzen einen abgerundeten Außendorn oder aber Dornen fehlen.
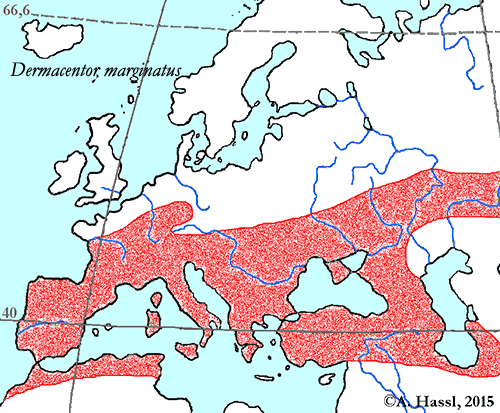 Verbreitung & Bionomie: Dermacentor marginatus ist die häufigste Zecke einer Nicht-Ixodes-Art in ⇒ Zentraleuropa. Diese Zecke wird als typisches Mitglied der Paläarktischen Faunenregion gesehen. cit. Estrada-Peña et Estrada-Peña [1991]. Und dies, obgleich warme, trockene, aber nicht wüstenhafte Gebiete in den Maghrebstaaten und in den anderen Mittelmeeranrainerstaaten der Art vermutlich die besten ⇒ Habitate bieten. Das Verbreitungsareal dieser Art reicht vom Altaigebirge über Kasachstan und Persien bis nach Nordafrika und Südwesteuropa, auch in Nordchina bestehen bestens geeignete Lebensräume. cit. Yang et al. [2020]. Es handelt sich um eine weitverbreitete und lokal häufige Art. Diese Tiere werden meist fokal konzentriert gefunden, besonders im Süden Mitteleuropas - ein Argument für ihre Abhängigkeit von der Existenz von Schafweiden. Tiere dieser Art besiedeln Steppen, Waldsteppen und trockene, gering bewaldete Flächen, also typische Schafweiden. Die Art lebt im trockenen, von Rasen bedecktem Brachland, das häufig eben als Weide in einer extensiven Schafhaltung genutzt wird, außerdem kommt die Art in den Wäldern und Weiden der Niederungen, in der alpinen Steppenzone und in südlichen Halbwüsten vor. In Frankreich besiedeln sie fast nur Eichenwälder. Im Südteil ihres Verbreitungsgebietes sind sie nur in großer Höhe, bis 3500 m, auf den Bergen zu finden.
Verbreitung & Bionomie: Dermacentor marginatus ist die häufigste Zecke einer Nicht-Ixodes-Art in ⇒ Zentraleuropa. Diese Zecke wird als typisches Mitglied der Paläarktischen Faunenregion gesehen. cit. Estrada-Peña et Estrada-Peña [1991]. Und dies, obgleich warme, trockene, aber nicht wüstenhafte Gebiete in den Maghrebstaaten und in den anderen Mittelmeeranrainerstaaten der Art vermutlich die besten ⇒ Habitate bieten. Das Verbreitungsareal dieser Art reicht vom Altaigebirge über Kasachstan und Persien bis nach Nordafrika und Südwesteuropa, auch in Nordchina bestehen bestens geeignete Lebensräume. cit. Yang et al. [2020]. Es handelt sich um eine weitverbreitete und lokal häufige Art. Diese Tiere werden meist fokal konzentriert gefunden, besonders im Süden Mitteleuropas - ein Argument für ihre Abhängigkeit von der Existenz von Schafweiden. Tiere dieser Art besiedeln Steppen, Waldsteppen und trockene, gering bewaldete Flächen, also typische Schafweiden. Die Art lebt im trockenen, von Rasen bedecktem Brachland, das häufig eben als Weide in einer extensiven Schafhaltung genutzt wird, außerdem kommt die Art in den Wäldern und Weiden der Niederungen, in der alpinen Steppenzone und in südlichen Halbwüsten vor. In Frankreich besiedeln sie fast nur Eichenwälder. Im Südteil ihres Verbreitungsgebietes sind sie nur in großer Höhe, bis 3500 m, auf den Bergen zu finden.
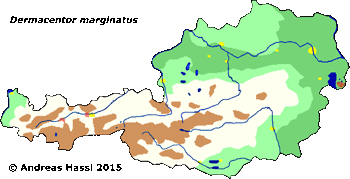 In Österreich leben sie nur in Wärmeinseln, auf sonnigen Hängen oder auf Trockenrasen. Ihre Verbreitung ist augenscheinlich auf stark bewachsene Geröllhalden und schüttere Wälder an südexponierten und damit warmen Hängen und auf Wälder mit starkem Unterwuchs in Wärmeinseln in der montanen Stufe beschränkt. Eine besonders hohe Dichte findet sich im Rheintal mit seinen Zuflüssen, wo intensiv die Weidehaltung von Schafen betrieben wird. Im warmen, trockenen Ostösterreich wurde diese Zecke jedoch nur einmal gefunden, in St. Andrä im Seewinkel (Belegexemplar NHMW). Das seltene Vorkommen im warmen Ostösterreich könnte entweder mit einer Teilstenoxenie oder mit der starken Abhängigkeit von Schafweiden, nicht aber Rinderweiden, als Lebensraum zu erklären sein.
In Österreich leben sie nur in Wärmeinseln, auf sonnigen Hängen oder auf Trockenrasen. Ihre Verbreitung ist augenscheinlich auf stark bewachsene Geröllhalden und schüttere Wälder an südexponierten und damit warmen Hängen und auf Wälder mit starkem Unterwuchs in Wärmeinseln in der montanen Stufe beschränkt. Eine besonders hohe Dichte findet sich im Rheintal mit seinen Zuflüssen, wo intensiv die Weidehaltung von Schafen betrieben wird. Im warmen, trockenen Ostösterreich wurde diese Zecke jedoch nur einmal gefunden, in St. Andrä im Seewinkel (Belegexemplar NHMW). Das seltene Vorkommen im warmen Ostösterreich könnte entweder mit einer Teilstenoxenie oder mit der starken Abhängigkeit von Schafweiden, nicht aber Rinderweiden, als Lebensraum zu erklären sein.
Adulte werden in Österreich nur zwischen Ende April und Ende Mai gefunden. Die Männchen saugen vor der Kopulation Blut. Während der Blutaufnahme der erwachsenen weiblichen Zecke findet in der Regel die Begattung statt. Die Überwinterung erfolgt in der Regel durch nüchterne Weibchen oder Nymphen. Die Adulttiere sind anderswo im Frühjahr und im Herbst aktiv. Die Larven und die Nymphen sind hingegen vor allem in den Sommermonaten anzutreffen. Eine vollständige Entwicklung (Schlupfvorgang bis zum Tod) dauert bei dieser Art im Freiland üblicherweise ein oder zwei Jahre, unter Laborbedingungen aber nur vier bis fünf Monate.
Wirte: Diese Art ist zwar eine drei-wirtige Zecke, jedoch mit nur gering ausgeprägter Telotropie. Als Wirte dienen den Adulttiere große und mittelgroße Säugetiere, insbesondere Haustiere. Die Larven und die Nymphen schmarotzen an kleinen Säugetieren. Die Adulttiere schmarotzen in Zentraleuropa häufig an Schafen. cit. Estrada-Peña et Jongejan [1999]. In Westeuropa saugen sie auch an Haushunden, an die sie den Blutparasiten Babesia canis (Piana et Galli-Valerio, 1895) übertragen können. Die Larven und Nymphen saugen ausschließlich an kleinen Säugern, zumeist an verschiedenen Nagetieren oder am Maulwurf. Die Adulttiere und die Nymphen befallen mit Vorliebe Menschen. cit. Estrada-Peña et Jongejan [1999] und Bursali et al. [2010]. Nach den Angaben der ersten Autorengruppe gehören 10% aller Zecken an Menschen dieser Art an.
- Heimische Wirte ohne Stadienunterscheidung:
- Primates: Homo sapiens Linnaeus, 1758 dt: Mensch.
- Artiodactyla: Cervus elaphus Linnaeus, 1758 dt: Rothirsch;
- Bos primigenius taurus Linnaeus, 1758 dt: Hausrind;
- Ovis orientalis aries Linnaeus, 1758 dt: Hausschaf.
- Eulipotyphla: Erinaceus europaeus Linnaeus, 1758 dt: Braunbrustigel;
- Talpa europaea Linnaeus, 1758 dt: Europäischer Maulwurf.
- Carnivora: Canis lupus familiaris (Linnaeus, 1758) dt: Haushund.
- Lagomorpha: Lepus europaeus Pallas, 1778 dt: Feldhase.
- Heimische Wirte der Larven:
- Rodentia: Muscardinus avellanarius ((Linnaeus, 1758) dt: Haselmaus;
- Myodes glareolus (Schreber, 1780) dt: Rötelmaus;
- Heimische Wirte der Larven und Nymphen:
- Carnivora: Canis lupus familiaris (Linnaeus, 1758) dt: Haushund.
- Eulipotyphla: Erinaceus europaeus Linnaeus, 1758 dt: Braunbrustigel;
- Sorex araneus Linnaeus, 1758 dt: Waldspitzmaus;
- Lagomorpha: Lepus europaeus Pallas, 1778 dt: Feldhase;
- Oryctolagus cuniculus (Linnaeus, 1758) dt: Kaninchen.
- Rodentia: Spermophilus citellus (Linnaeus, 1766) dt: Europäisches Ziesel;
- Eliomys quercinus (Linnaeus, 1766) dt: Gartenschläfer;
- Dryomys nitedula (Pallas, 1778) dt: Baumschläfer;
- Apodemus flavicollis (Melchior, 1834) dt: Gelbhalsmaus;
- Apodemus sylvaticus (Linnaeus, 1758) dt: Waldmaus;
- Microtus arvalis (Pallas, 1778) dt: Feldmaus;
- Apodemus uralensis (Pallas, 1811) dt: Uralfeldmaus;
- Apodemus agrarius (Pallas, 1871 dt: Brandmaus.
- Heimische Wirte der Adulten:
- Artiodactyla: Capra aegagrus hircus Erxleben, 1777 dt: Hausziege;
- Ovis orientalis aries Linnaeus, 1758 dt: Hausschaf;
- Cervus elaphus Linnaeus, 1758 dt: Rothirsch;
- Bos primigenius taurus Linnaeus, 1758 dt: Hausrind;
- Capreolus capreolus (Linnaeus, 1758) dt: Reh;
- Sus scrofa domestica Linnaeus, 1758 dt: Hausschwein;
- Sus scrofa Linnaeus, 1758 dt: Wildschwein; cit. Satta et al. [2011].
- Perissodactyla: Equus ferus caballus Linnaeus, 1758 dt: Hauspferd.
- Carnivora: Canis lupus familiaris (Linnaeus, 1758) dt: Haushund.
- Liste verändert cit. Merdivenci [1969].
Vektorfunktion: Dermacentor marginatus kann als ⇒ Überträger des Erregers der Tularämie Francisella tularensis (McCoy et Chapin, 1912), von Rickettsia slovaca Sekeyová et al., 1998, dem Erreger von TIBOLA (einer Zecken-übertragene Lymphadenopathie, tick - borne lymphadenopathy), der Erreger des Erve-Virus-Fiebers, der Bhanja-Arbovirose und des Q-Fiebers, dessen Erreger Coxiella burnetii (Derrick, 1939) ist, fungieren. Zecken dieser Art tragen in Sardinien Ehrlichia canis (Donatien et Lestoquard, 1935), den Erreger der kaninen Ehrlichiose in sich. cit. Satta et al. [2011] Angeblich soll diese Zecken-Art der wichtigste Arthropodenvektor für das Q-Fieber sein, in Österreich gibt es allerdings keinen einzigen bewiesenen Q-Fieber-Fall mit diesem Übertragungsweg.
Dermacentor reticulatus (Fabricius, 1794)
dt: Auwaldzecke
Abb. VIII.2.X: Dermacentor reticulatus ♀.
© unbekannt.
Synonyme:
Acarus reticulatus Fabricius, 1794;
Ixodes reticulatus (Fabricius, 1794);
Cynorhaestes pictus Hermann, 1804;
Dermacentor pictus (Hermann), 1804;
Ixodes pictus (Hermann), 1804;
Dermacentor ferrugineus (Hermann), 1804;
Ixodes holsatus Kolenati, 1857;
Ixodes marmoratus Mégnin, 1880;
Dermacentor pardalinus Koch, 1844.
Weibchen:  Die weiblichen Zecken dieser Art sind 3,3 mm lang und 2,7 mm breit. Ihr Scutum ist rund, etwa 1,4 x 1,4 mm groß. cit. Nosek et Sixl [1972]. Die größte Breite wird in Höhe der Augen erreicht. Die Scapulae sind groß und stumpf. Die ⇒ Basis capituli trägt gut entwickelte ⇒ Cornua. Die ⇒ Areae porosae sind groß und rund. Das zweite Glied der Palpen ist breiter als das dritte. Die Nahtlinie zwischen den beiden ist markant. An der hinteren äußeren Seite des zweiten Glieds sitzt ein nach hinten gerichteter kräftiger Dorn. Auf der Spirakularöffnung liegt schräg die längliche Macula. Die ⇒ Coxen des ersten Beinpaares sind bis über die Hälfte längs eingeschnitten. Die Coxen der zweiten bis vierten Beinpaares sind abgerundet. Die Außendornen sind groß und stumpf.
Die weiblichen Zecken dieser Art sind 3,3 mm lang und 2,7 mm breit. Ihr Scutum ist rund, etwa 1,4 x 1,4 mm groß. cit. Nosek et Sixl [1972]. Die größte Breite wird in Höhe der Augen erreicht. Die Scapulae sind groß und stumpf. Die ⇒ Basis capituli trägt gut entwickelte ⇒ Cornua. Die ⇒ Areae porosae sind groß und rund. Das zweite Glied der Palpen ist breiter als das dritte. Die Nahtlinie zwischen den beiden ist markant. An der hinteren äußeren Seite des zweiten Glieds sitzt ein nach hinten gerichteter kräftiger Dorn. Auf der Spirakularöffnung liegt schräg die längliche Macula. Die ⇒ Coxen des ersten Beinpaares sind bis über die Hälfte längs eingeschnitten. Die Coxen der zweiten bis vierten Beinpaares sind abgerundet. Die Außendornen sind groß und stumpf.
Männchen: 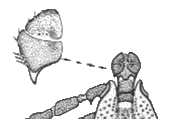 Der Körper ist oval. Die Oberfläche des Scutums ist gleichmäßig mit feinen Punkten besetzt. Die Zervikalfurchen sind halbmondförmig und kurz. Die Lateralfurchen sind flach. Die Außenseiten der ⇒ Basis capituli sind parallel. Anstelle der ⇒ Areae porosae sitzen auf der Oberseite mehrere große Sensillen. Die Basis trägt zwei große, nach hinten gerichtete, spitze ⇒ Cornua. Die Palpen sind kurz und gedrungen. Ihr zweites Glied ist breiter und länger als das dritte. An der hinteren Außenseite des zweiten Gliedes befindet sich ein mächtiger nach hinten gerichteter spitzer Stachel. Das ⇒ Hypostom ist keulenförmig und im vorderen Viertel am breitesten. Die Spitze hat zwei ⇒ konkav gekrümmte Seiten. Es trägt je drei Längsreihen von Zähnen. Die Spirakularplatte ist länglich. Die Coxen des ersten bis dritten Beinpaares ähneln denen des Weibchens, die Dornen sind aber länger und spitz. Die Coxen des vierten Beinpaares sind hinten stark vergrößert. An den anderen Beingliedern sitzen meist je drei Dornen.
Der Körper ist oval. Die Oberfläche des Scutums ist gleichmäßig mit feinen Punkten besetzt. Die Zervikalfurchen sind halbmondförmig und kurz. Die Lateralfurchen sind flach. Die Außenseiten der ⇒ Basis capituli sind parallel. Anstelle der ⇒ Areae porosae sitzen auf der Oberseite mehrere große Sensillen. Die Basis trägt zwei große, nach hinten gerichtete, spitze ⇒ Cornua. Die Palpen sind kurz und gedrungen. Ihr zweites Glied ist breiter und länger als das dritte. An der hinteren Außenseite des zweiten Gliedes befindet sich ein mächtiger nach hinten gerichteter spitzer Stachel. Das ⇒ Hypostom ist keulenförmig und im vorderen Viertel am breitesten. Die Spitze hat zwei ⇒ konkav gekrümmte Seiten. Es trägt je drei Längsreihen von Zähnen. Die Spirakularplatte ist länglich. Die Coxen des ersten bis dritten Beinpaares ähneln denen des Weibchens, die Dornen sind aber länger und spitz. Die Coxen des vierten Beinpaares sind hinten stark vergrößert. An den anderen Beingliedern sitzen meist je drei Dornen.
Nymphe: Die Nymphen verbringen die erste, noch immobile Phase meist in der Exuvie der Larve bis ihre Kutikula erhärtet und damit dunkel geworden ist. Nach der ersten Kotablage ist die Nymphe nach weiteren drei bis sieben Tagen zur Blutaufnahme bereit. Diese Zeit fällt in die Monate Juli und August. Nach vier bis sieben Tagen verlassen die Nymphen ihren Wirt und häuten sich noch im Sommer zu den Adulttiere.
Larve: Die Larven von Dermacentor reticulatus schlüpfen erst, wenn die Temperatur der Umgebung und die relative Luftfeuchtigkeit im Frühling Mindestwerte erreicht haben. Die Temperatur muss zwischen 20° und 34°C liegen. Die aus dem Ei geschlüpfte sechsbeinige Larve ist erst nach einem gewissen Reifestadium zur Blutaufnahme bereit, denn die Kutikula der geschlüpften Larve ist noch weich und pigmentarm. Erst nach einer Zeitspanne von vier bis sieben Tagen ist die nötige Härte und Pigmentation der Kutikula erreicht, um den schädigenden Einwirkungen der Umwelt zu widerstehen. Bis dahin verbleibt die Zecke in ihrem Schlupfwinkel, wo sie vor Licht und Austrocknung geschützt ist. Dieser Zeitpunkt fällt in die Monate Juni oder Juli. Hungernden Larven leben bei 5°C und 100%iger Feuchtigkeit bis zu 83,5 Tagen. cit. Menn [2006].
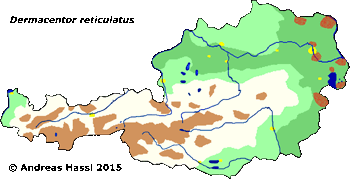
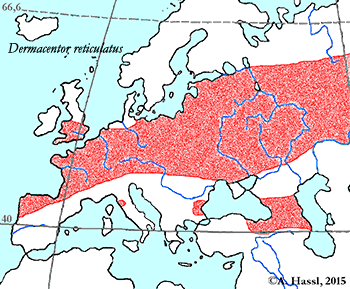 Verbreitung: Dermacentor reticulatus ist quer über Festlandeuropa verbreitet. Fundpunkte gibt es in Österreich, Weißrussland, Belgien, Großbritannien, Bulgarien, Korsika, Tschechische Republik, Frankreich, Deutschland, Griechenland, Ungarn, Italien, Mazedonien, Polen, Portugal, Rumänien, Russland, Sardinien, Spanien, Schweiz, Ukraine und dem ehemaligen Jugoslawien. Das Verbreitungsgebiet der Auwaldzecke hat sich seit den 1970er Jahren von Ungarn, Österreich und Norditalien aus nach Norden ausgedehnt. In Deutschland wurde die erste ⇒ allochthone Population 1973 am Oberrhein beschrieben, inzwischen gibt es sie aber in ganz Deutschland. In Österreich wurde die Auwaldzecke im Seewinkelgebiet (Apetlon, Burgenland) und in Sieggraben (Burgenland), sowie in der Lobau bei Wien, in Kloster- und Korneuburg (unveröffentlichte Beobachtungen) gefunden. cit. Sixl et al. [1971].
Verbreitung: Dermacentor reticulatus ist quer über Festlandeuropa verbreitet. Fundpunkte gibt es in Österreich, Weißrussland, Belgien, Großbritannien, Bulgarien, Korsika, Tschechische Republik, Frankreich, Deutschland, Griechenland, Ungarn, Italien, Mazedonien, Polen, Portugal, Rumänien, Russland, Sardinien, Spanien, Schweiz, Ukraine und dem ehemaligen Jugoslawien. Das Verbreitungsgebiet der Auwaldzecke hat sich seit den 1970er Jahren von Ungarn, Österreich und Norditalien aus nach Norden ausgedehnt. In Deutschland wurde die erste ⇒ allochthone Population 1973 am Oberrhein beschrieben, inzwischen gibt es sie aber in ganz Deutschland. In Österreich wurde die Auwaldzecke im Seewinkelgebiet (Apetlon, Burgenland) und in Sieggraben (Burgenland), sowie in der Lobau bei Wien, in Kloster- und Korneuburg (unveröffentlichte Beobachtungen) gefunden. cit. Sixl et al. [1971].
Bionomie: Die Adulttiere dieser Zecken-Art verhalten sich erkennbar ⇒ exophil, dh sie meiden die menschlichen Behausungen und auch Tierbauten. Sie sind meist auf der Vegetation anzutreffen und somit stark den Witterungseinflüssen ausgesetzt. Ihre Aktivität richtet sich infolgedessen weitgehend nach den lokalklimatischen Bedingungen. Ist die Zecke zur Nahrungsaufnahme bereit, kriecht sie auf Grashalme- den krautigen Unterwuchs, um dort einen Wirt zu suchen. Es sind zur Wirtssuche aktiv herumkriechende Zecken, keine ⇒ Lauerjäger wie die Ixodes-Arten, weshalb sie manchmal auch „Laufzecken” genannt werden. Adulte Tiere dieser Art können allerdings mit der Zeckenfahne erfolgreich abgefangen werden, nicht aber die Subadulten oder andere Dermacentor-Arten.
In Apetlon wurden Adulttiere auf Sträuchern in der Nähe von Sümpfen gefunden, in Sieggraben in einer feuchten Talmulde am Rande eines Kahlschlags. Diese Spezies kommt in Österreich hauptsächlich in Sumpfniederungen und Mischwäldern entlang von Flussläufen vor, in denen nach der Schneeschmelze Überschwemmungen auftreten. Es werden Laubwaldlichtungen und Schonungen, von Gebüsch umstandene Viehweiden und die Vegetation entlang von Waldpfaden, Seeufern und Drainagegräben bevorzugt besiedelt. Die Auwaldzecke lebt bevorzugt in feuchten Gebieten wie Auwälder und Moore, sowie Laubwälder. Auwaldzecken benötigen eine Sommerdurchschnittstemperatur von 20 bis 22°C. Der Jahresniederschlag sollte zwischen 400 und 1000 mm liegen. Diese Zecken sind kältetolerant und überstehen auch kalte Winter. Die adulten Tiere sind im Winter sogar aktiv, im Dezember konnte noch ein Befall eines Hundes festgestellt werden. Es ist die Zecke mit der wohl höchsten ⇒ Tenazität in Österreich, sie taucht auch nach Überschwemmungen nach kurzer Zeit wieder auf. Die Adulttiere entwickeln ihre höchste Aktivität bei Tagesdurchschnittstemperaturen von nur 4 bis 13 °C, bei einer Luftfeuchte unter 65% werden sie allerdings inaktiv. Die erste Saisonaktivität der Adulttiere beginnt Ende Februar mit der Schneeschmelze und endet mit dem Blattaustrieb Anfang Mai. Der Höhepunkt der Aktivität ist im März. Von September bis Oktober werden die Zecken dann allerdings wieder aktiv. Diese aktive Herbstgeneration besteht aus Tieren, die im Frühjahr keinen Wirt gefunden haben und/oder aus Zecken der nächsten Generation. Die Adulttiere sind also zu zwei Zeiten im Jahr aktiv, einerseits im Spätwinter bis in das Frühfrühjahr und andererseits im Herbst. Adulttiere haben also ein ausgeprägtes ⇒ bimodales Aktivitätsmuster. Die Subadulten sind wahrscheinlich unimodal im Sommer aktiv. cit. Bartosik et al. [2011]. Die Männchen saugen vor der Kopulation Blut. Während der Blutaufnahme der erwachsenen weiblichen Zecke findet in der Regel die Begattung statt. Unter natürlichen Bedingungen dauert der ganze Entwicklungszyklus ein bis 1,5 Jahre.
Wirte: Diese Art ist eine drei-wirtige Zecke. Die Larven und Nymphen sind wirtsunspezifisch und saugen an Mäusen und anderen Kleinsäugern wie Hasen und Igeln. Die Adulttiere bevorzugen trotz ihrer Exophilie Haustiere, in Polen jedoch den Elch. cit. Kolonin [2009]. Die Adulttiere und die Nymphen dieser Zecke saugen aber auch nicht ungern am Menschen Blut, angeblich gerade auch in Österreich. cit. Estrada-Peña et Jongejan [1999].
- Heimische Wirte ohne Stadienunterscheidung:
- Artiodactyla: Alces alces (Linnaeus, 1758) dt: Elch;
- Cervus elaphus Linnaeus, 1758 dt: Rothirsch;
- Capreolus capreolus (Linnaeus, 1758) dt: Reh;
- Dama dama (Linnaeus, 1758) dt: Dammhirsch; cit. Dautel et al. [2006];
- Sus scrofa Linnaeus, 1758 dt: Wildschwein; cit. Schebek [2013];
- Bison bonasus (Linnaeus, 1758) dt: Wisent;
- Bos primigenius taurus Linnaeus, 1758 dt: Hausrind.
- Carnivora: Canis lupus familiaris (Linnaeus, 1758) dt: Haushund;
- Vulpes vulpes (Linnaeus, 1758) dt: Rotfuchs; cit. Schebek [2013].
Vektorfunktion: Diese Spezies ist wahrscheinlich ein ⇒ Überträger von Rickettsia slovaca Sekeyová et al., 1998, dem Erreger der TIBOLA (tick - borne lymphadenopathy) und sicher ein ⇒ Vektor für das Virus der Frühsommer-Meningoenzephalitis (FSME). Des Weiteren wird von dieser Art wahrscheinlich das Virus des Omsker Hämorrhagischen Fiebers, Rickettsia helvetica Beati et al., 1993, Rickettsia sibirica Zdrodovski et Golinevich, 1948, Rickettsia conorii Brumpt, 1932, der Erreger des Mittelmeerfleckfiebers, Coxiella burnetii (Derrick, 1939), der Erreger des Q-Fiebers, und Francisella tularensis (McCoy et Chapin, 1912), der Erreger der Tularämie, übertragen.
 Andreas R. Hassl
Andreas R. Hassl


